 悩む人
悩む人同位体って何?同素体とは何が違うの?
このような悩みで手が止まっていませんか?
同位体と同素体は一見似たように聞こえますが全く違います。
そこで、今回は
同位体について、同素体との違いについても説明しながら、実践問題を通してわかりやすく解説していきます !
本記事は以下のような人におすすめです!
- 同位体と同素体の違いが分からない。
- 同位体に関する問題が解けない。



この記事を読んで、同位体と同素体の違いを説明できるようになろう!
問題
天然の酸素原子には\(\mathrm{^{16}_{8}O , \, ^{17}_{8}O , \, ^{18}_{8}O}\)がある。次の各問いに答えよ。
(1) これらの原子の関係をなんというか。
(2) \(\mathrm{^{16}_{8}O , \, ^{17}_{8}O , \, ^{18}_{8}O}\)について、陽子の数、中性子の数、電子の数をそれぞれ求めよ。
(3) これらの3種類の酸素原子を組み合わせると、何種類の酸素分子\(\mathrm{O_2}\)ができるか。
2020セミナー化学基礎 | 第一学習社
略解
(1) 同位体
(2)
| 原子 | 陽子の数 | 中性子の数 | 電子の数 |
| \(\mathrm{^{16}_{8}O}\) | 8 | 8 | 8 |
| \(\mathrm{^{17}_{8}O}\) | 8 | 9 | 8 |
| \(\mathrm{^{18}_{8}O}\) | 8 | 10 | 8 |
(3) 6種類
テキスト:同位体
それでは、この問題に必要な知識・ポイントを確認していきましょう。
同位体と同素体の違い
まず、同位体と同素体の違いについて説明します。
それぞれの定義について確認しましょう。
- 同位体(アイソトープ):原子番号が等しく、質量数が異なる原子。
- 同素体:同じ元素の単体で、構造や性質の異なるもの。



定義だけではいまいちピンとこない…
では、具体例を交えて説明します。
まずは同位体についてです。
同位体(アイソトープ):原子番号が等しく、質量数が異なる原子。
例えば、水素の同位体は3つ存在します。
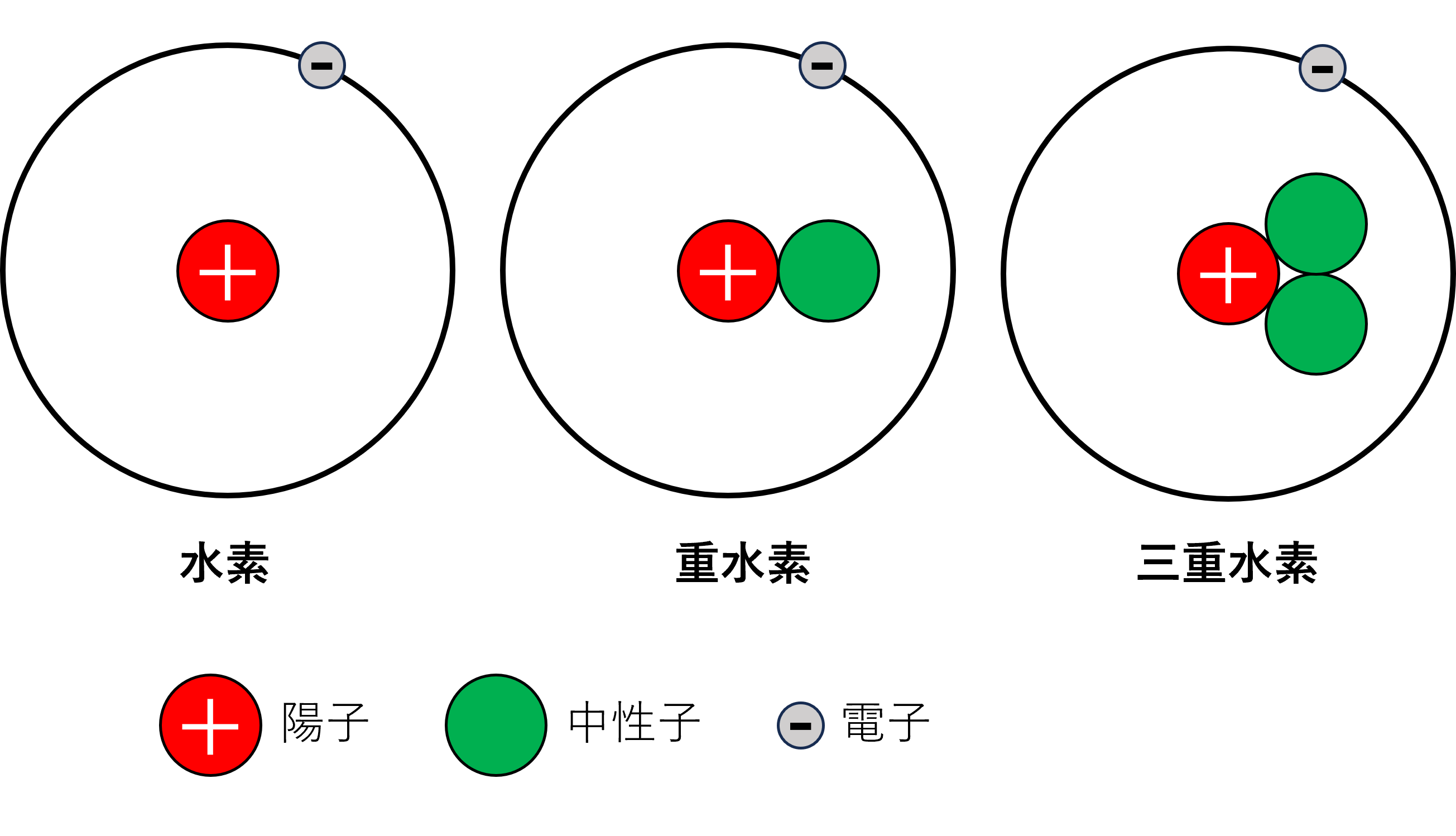

中性子の数が1つのものを水素、2つのものを重水素、3つのものを三重水素といいます。
これら3つは、全て水素原子からなるため原子番号は等しく1です。
しかし、中性子の数が違うため質量数が異なります。
陽子、中性子、電子の質量比は1:1:\(\displaystyle\frac{1}{1840}\)であるので、
水素、重水素、三重水素の質量数はそれぞれ、1, 2, 3となります。
つまりこれらを原子番号と質量数の表し方で表すと以下のようになります。
- 水素→\(\mathrm{^{1}_{1}H}\)
- 重水素→\(\mathrm{^{2}_{1}H}\)
- 三重水素→\(\mathrm{^{3}_{1}H}\)



ちゃんと原子番号(左下)は一緒だけど、質量数(左上)は異なるね!
この他にも、
炭素の同位体 \(\mathrm{^{12}_{6}C, \, ^{13}_{6}C, \, ^{14}_{6}C}\)
窒素の同位体 \(\mathrm{^{14}_{7}N, \, ^{15}_{7}N}\)
酸素の同位体 \(\mathrm{^{16}_{8}O , \, ^{17}_{8}O , \, ^{18}_{8}O}\)
塩素の同位体 \(\mathrm{^{35}_{17}Cl , \, ^{37}_{17}Cl}\)
銅の同位体 \(\mathrm{^{63}_{29}Cu , \, ^{65}_{29}Cu}\)
などがあります。
次に、同素体についてです。
同素体:同じ元素の単体で、構造や性質の異なるもの。
同素体は同じ元素からなるもの同士を指すので、化学式等での区別が難しいです。
しかし、一般的な同素体は4種類だけなので、表1の4種類を覚えてしまいましょう。
| 構成元素 | 同素体の例 |
|---|---|
| 炭素\(\mathrm{C}\) | ダイヤモンド\(\mathrm{C}\), 黒鉛\(\mathrm{C}\), フラーレン\(\mathrm{C_{60}}\), カーボンナノチューブ |
| 酸素\(\mathrm{O}\) | 酸素\(\mathrm{O_2}\), オゾン\(\mathrm{O_3}\) |
| リン\(\mathrm{P}\) | 黄リン\(\mathrm{P_4}\), 赤リン\(\mathrm{P}\) |
| 硫黄\(\mathrm{S}\) | 斜方硫黄\(\mathrm{S_8}\), 単斜硫黄\(\mathrm{S_8}\), ゴム状硫黄\(\mathrm{S}\) |
この4種類の覚え方は、
硫黄の\(\mathrm{S}\)、炭素の\(\mathrm{C}\)、酸素の\(\mathrm{O}\)、リンの\(\mathrm{P}\)
をとって、「同素体SCOP」と覚えると簡単です。
これらを踏まえて、問題の解説を確認していきましょう。
解説
天然の酸素原子には\(\mathrm{^{16}_{8}O , \, ^{17}_{8}O , \, ^{18}_{8}O}\)がある。次の各問いに答えよ。
(1) これらの原子の関係をなんというか。
(2) \(\mathrm{^{16}_{8}O , \, ^{17}_{8}O , \, ^{18}_{8}O}\)について、陽子の数、中性子の数、電子の数をそれぞれ求めよ。
(3) これらの3種類の酸素原子を組み合わせると、何種類の酸素分子\(\mathrm{O_2}\)ができるか。
2020セミナー化学基礎 | 第一学習社
- (1) これらの原子の関係をなんというか。
-
\(\mathrm{^{16}_{8}O , \, ^{17}_{8}O , \, ^{18}_{8}O}\)
これら3つは、原子番号は等しいが質量数が異なる原子であるため同位体です。
A. 同位体
- (2) \(\mathrm{^{16}_{8}O , \, ^{17}_{8}O , \, ^{18}_{8}O}\)について、陽子の数、中性子の数、電子の数をそれぞれ求めよ。
-
質量数=陽子の数+中性子の数
原子番号=陽子の数=電子の数
を考えると以下の表のようにまとめられます。
原子 陽子の数 中性子の数 電子の数 \(\mathrm{^{16}_{8}O}\) 8 8 8 \(\mathrm{^{17}_{8}O}\) 8 9 8 \(\mathrm{^{18}_{8}O}\) 8 10 8 - (3) これらの3種類の酸素原子を組み合わせると、何種類の酸素分子\(\mathrm{O_2}\)ができるか。
-
酸素原子の同位体は合計で3種類あります。
よって、酸素分子を作る際、次の6種類の組み合わせが考えられます。
\(\mathrm{^{16}O}\) と \(\mathrm{^{16}O}\)
\(\mathrm{^{16}O}\) と \(\mathrm{^{17}O}\)
\(\mathrm{^{16}O}\) と \(\mathrm{^{18}O}\)\(\mathrm{^{17}O}\) と \(\mathrm{^{17}O}\)
\(\mathrm{^{17}O}\) と \(\mathrm{^{18}O}\)\(\mathrm{^{18}O}\) と \(\mathrm{^{18}O}\)
よって、
\(\mathrm{^{16}O_2 , \, ^{16}O^{17}O, \, ^{16}O^{18}O , \, ^{17}O_2 , \, ^{17}O^{18}O , \, ^{18}O_2}\)
の合計6種類が考えられる。
A. 6種類
まとめ
今回は、同位体と同素体の違いについて解説しました。
同位体は、陽子、中性子、電子、それぞれの数が大きく関係してきます。
これら原子の構成については下記記事で詳しく解説しているので、是非チェックしてみてください!


本記事の重要事項を以下にまとめました。ぜひ復習に役立ててください!
- 同位体(アイソトープ)の定義は?
- 同素体の定義は?
- 同位体と同素体の違いは?
下記SNSにて、情報発信&質問対応を行っています。
質問については、本サイト内の内容に限らず勉強の相談等なんでもOKです。
本サイト運営者のかんたが直接お答えしております。お気軽にお問い合わせください!
X(旧Twitter)
LINE
Instagram
YouTube


質問・コメント