 悩む人
悩む人原子の電子配置が書けない…
このような悩みで手が止まっていませんか?
原子の電子配置は、電子殻と呼ばれる「電子の部屋」の性質を理解すれば簡単に書けるようになります。
そこで、今回は
原子の電子配置や価電子について、図解と実践問題を通してわかりやすく解説していきます!
本記事は以下のような人におすすめです!
- 原子の電子配置が書けない。
- 価電子の数え方が分からない。



この記事を読んで、原子の電子配置を一発で書けるようになろう!
問題
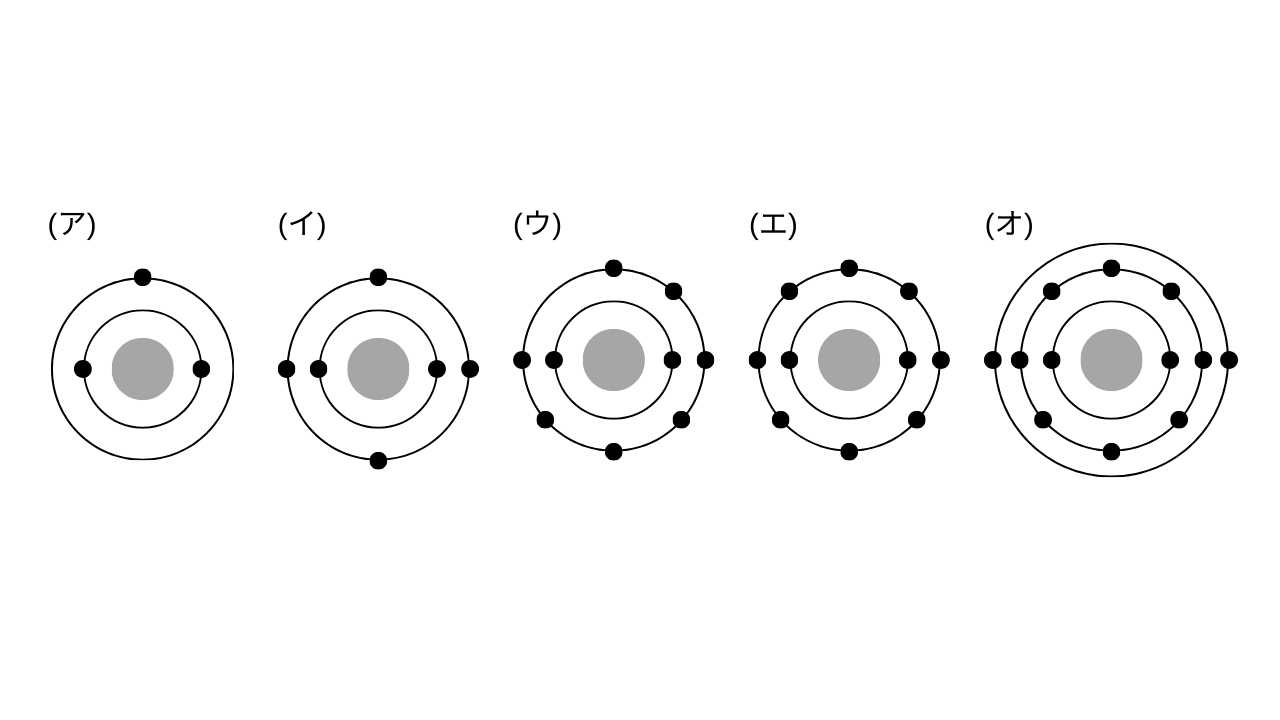
次の電子配置をもつ原子について、下の各問いに答えよ。
(1) (ア)~(オ)の各原子の名称を記せ。
(2) (ウ)の原子の最外殻には、あと最大何個の電子を収容することができるか。
(3) (ア)~(オ)の各原子の価電子の数はいくらか。
(4) \(\mathrm{_8O}\)および\(\mathrm{_{17}Cl}\)について、その電子配置を図にならって示せ。
2020セミナー化学基礎 | 第一学習社
略解
略解
(1) (ア) リチウム、(イ) 炭素、(ウ) フッ素、(エ) ネオン、(オ) マグネシウム
(2) 1個
(3) (ア) 1、(イ) 4、(ウ) 7、(エ) 0、(オ) 2
(4)

テキスト
それでは、この問題に必要な知識・ポイントを確認していきましょう。
電子殻とは電子の収容部屋
まず最初に、電子殻について説明していきます。
原子の構造から、電子は原子核の周りを取りまいていることがわかりました。(以下参照)


その電子について詳しく見ると、電子殻と呼ばれるいくつかの層に分かれて原子核の周りに存在しているのです。
具体的に図を使って説明いていきます。
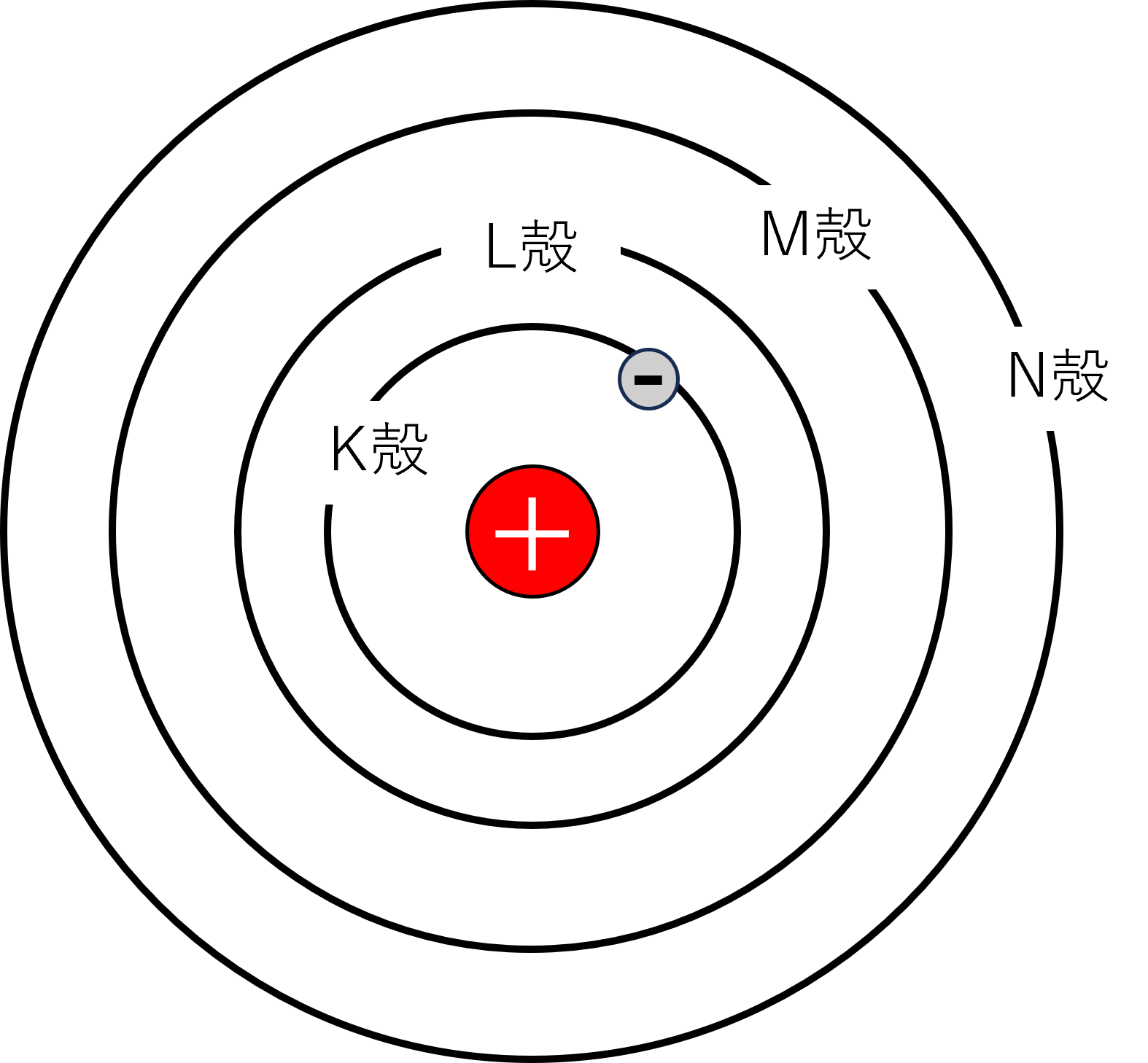

上の図は真ん中の原子核の周りに存在する電子殻を表したものです。
電子殻は原子核に近いものから順番に、K殻、L殻、M殻、N殻…と名前がつけられています。
電子は、この電子殻に入って原子核の周りを取りまいているのです。



つまり、電子殻は電子が入っている部屋っていうイメージだね!
それぞれの電子殻に入ることのできる電子の最大数は予め決まっています。
K殻、L殻、M殻、N殻…の順番で、2個、8個、18個、32個…の電子が収容できます。
これを式で表すと、次のようになります。
内側からn番目の電子殻に入る電子の数=\(\mathrm{2 \times n^2}\)
この式に当てはめると上の数があっていることがわかります。
電子配置は電子の収容順と収容人数
先程、K殻、L殻、M殻、N殻…の順番で、2個、8個、18個、32個…の電子が収容できる、といいました。
しかし、これらは収容できる電子の最大数なのです。
実際の原子は、K殻に2電子、それ以外の殻には8電子までしか収容することができません。



これじゃあ式が成り立たない。どういうこと?
これは、具体例を使って説明していきます。


例えば、原子番号11のナトリウム\(\mathrm{Na}\)について考えます。
ナトリウムは電子を11個持っているので、それを電子殻に収容していきましょう。
ここで、先程のポイントに注意します。
K殻に2電子、それ以外の殻には8電子までしか収容することができない。
よって、K殻に2電子、L殻に8電子、M殻に1電子が入ることになります。
K殻に2電子、L殻二8電子、M殻に1電子入っている場合しばしば次のように表記します。
K2, L8, M1



このように表記すると、何殻に何電子入っているかがわかりやすいね!
価電子の数え方
次に、価電子について説明します。
価電子は次のように定義されます。



結合するときなどに重要な役割をする電子…ってどれ?
結合に重要な役割をする電子は、ズバリ最外殻電子のことです。
最外殻電子とは、原子の最も外側の電子殻にある電子のことです。
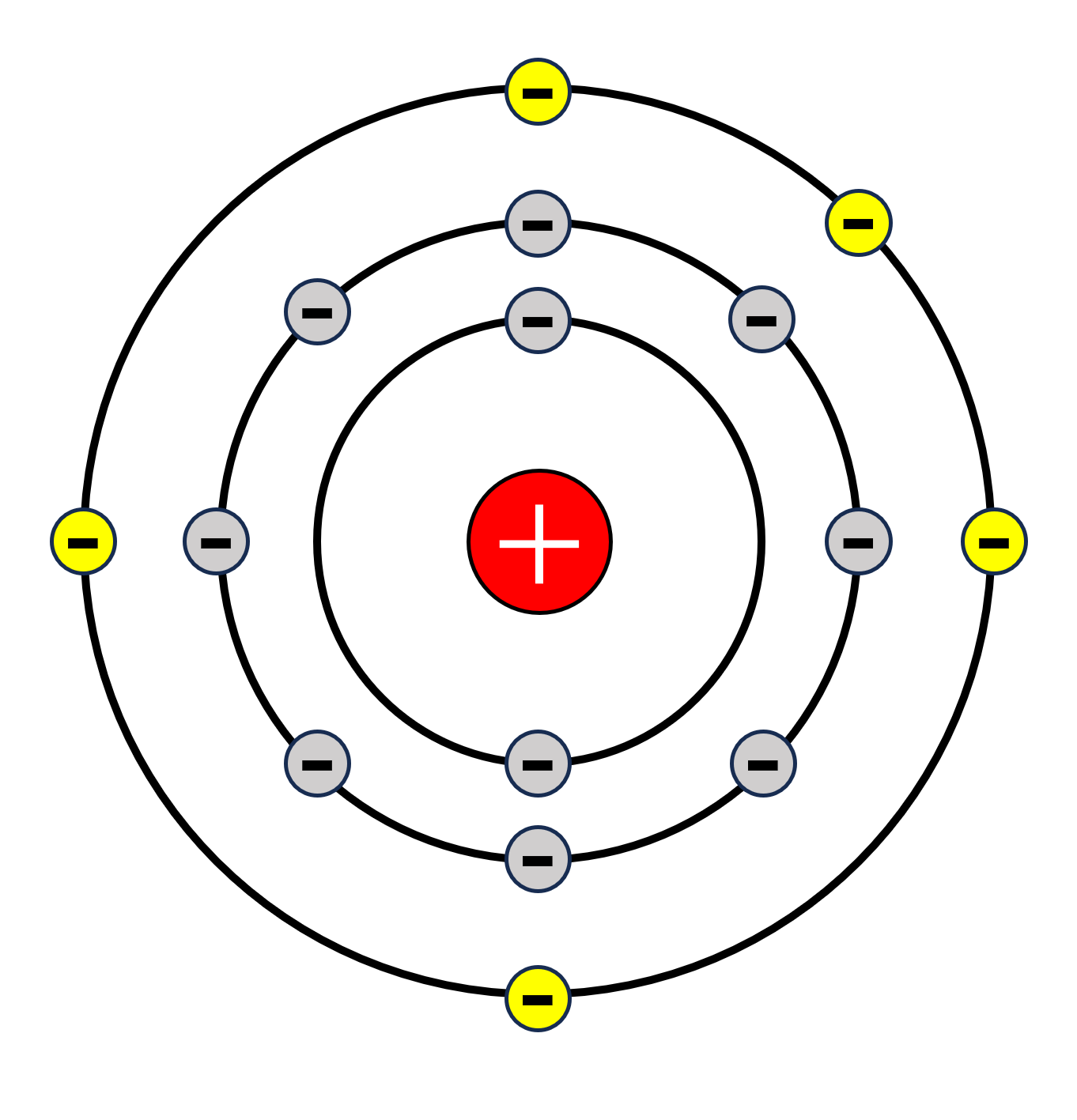

上の図のような原子の場合、最外殻電子は一番外側の電子殻にある黄色で示した電子です。
これらの電子は、他の原子と結合する際に非常に重要になってくるので、内側の電子とは区別されます。
また、重要な電子=価値がある電子ということで、これらの電子は価電子と呼ばれます。
貴ガスが安定な理由
最後に少し例外的に考えなくてはいけない貴ガスについて説明します。
貴ガスは18族の元素の総称で、これらの原子の電子配置を見てみると次のようになっています。
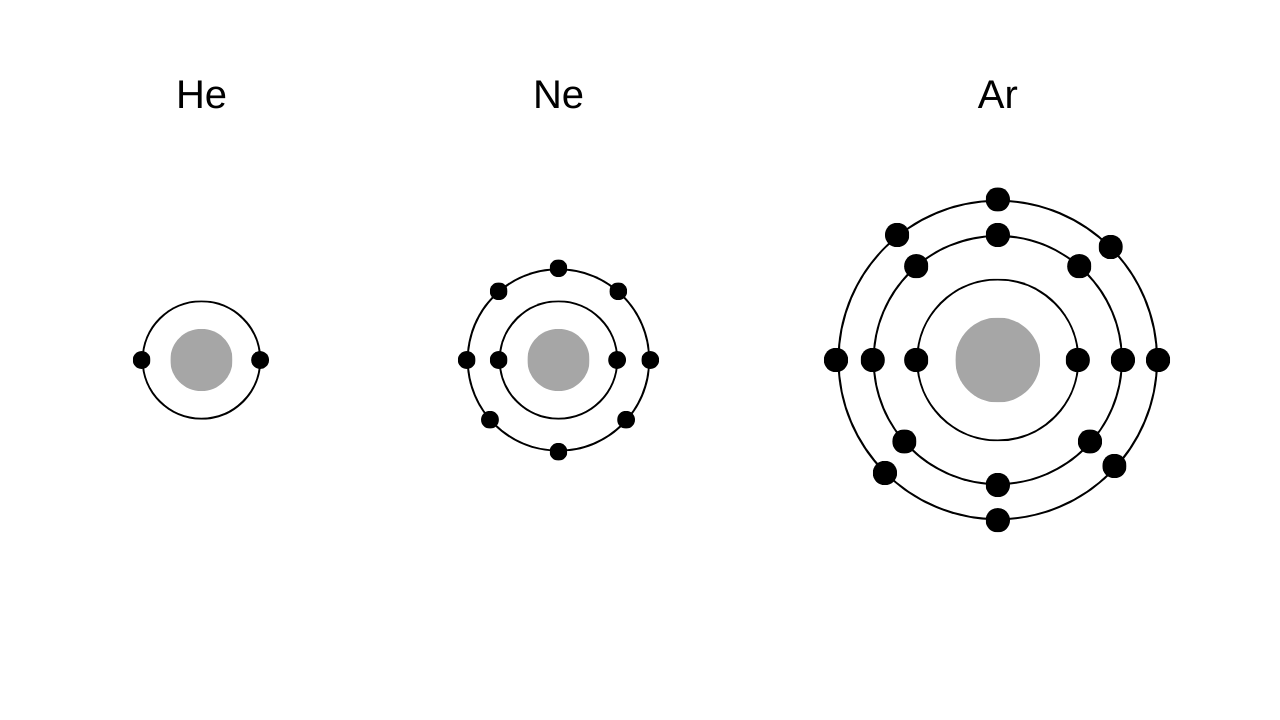

\(\mathrm{He , \, Ne , \, Ar}\)について、それぞれK殻、L殻、M殻が電子で埋まっています。



K殻には2電子、L殻、M殻にはそれぞれ8電子までしか入らないんだったね!
よって、これら貴ガス電子は最外殻電子が埋まってしまっているため、他の原子と反応しづらいのです。
貴ガスは他の原子と反応しないため1個の原子が分子として振る舞います。
よって、貴ガスは単原子分子となります。
また、他の原子との反応などに利用される電子がないということは、貴ガスは価電子が0であるとみなせます。
つまり、貴ガスは自信のみで非常に安定であるといえます。
これらを踏まえて、問題の解説を確認していきましょう。
解説
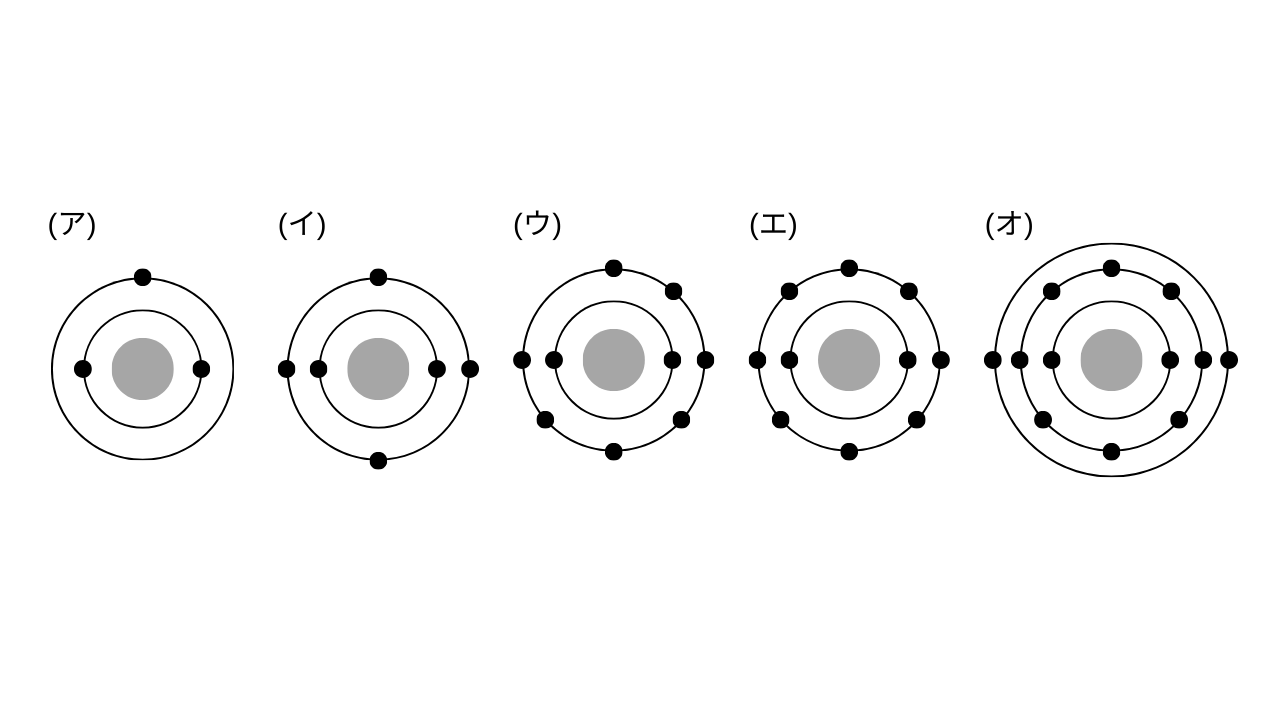
次の電子配置をもつ原子について、下の各問いに答えよ。
(1) (ア)~(オ)の各原子の名称を記せ。
(2) (ウ)の原子の最外殻には、あと最大何個の電子を収容することができるか。
(3) (ア)~(オ)の各原子の価電子の数はいくらか。
(4) \(\mathrm{_8O}\)および\(\mathrm{_{17}Cl}\)について、その電子配置を図にならって示せ。
2020セミナー化学基礎 | 第一学習社
- (1) (ア)~(オ)の各原子の名称を記せ。
-
原子番号=電子の数が成り立つので、電子の数から何の原子か判断していきます。
(ア) 電子が3個なので原子番号3のリチウム\(\mathrm{Li}\)です。
(イ) 電子が6個なので原子番号6の炭素\(\mathrm{C}\)です。
(ウ) 電子が9個なので原子番号9のフッ素\(\mathrm{F}\)です。
(エ) 電子が10個なので原子番号10のネオン\(\mathr{Ne}\)です。
(オ) 電子が12個なので原子番号12のマグネシウム\(\mathrm{Mg}\)です。
A. (ア) リチウム、(イ) 炭素、(ウ) フッ素、(エ) ネオン、(オ) マグネシウム
- (2) (ウ)の原子の最外殻には、あと最大何個の電子を収容することができるか。
-
L殻には8個の電子を収容できてすでに7個入っているので、あと1個の電子を収容できます。
A. 1個
- (3) (ア)~(オ)の各原子の価電子の数はいくらか。
-
それぞれ最外殻電子に収容されている電子の数を数えればいいです。
しかし、(エ)のネオンは貴ガスなので価電子は0です。
A. (ア) 1、(イ) 4、(ウ) 7、(エ) 0、(オ) 2
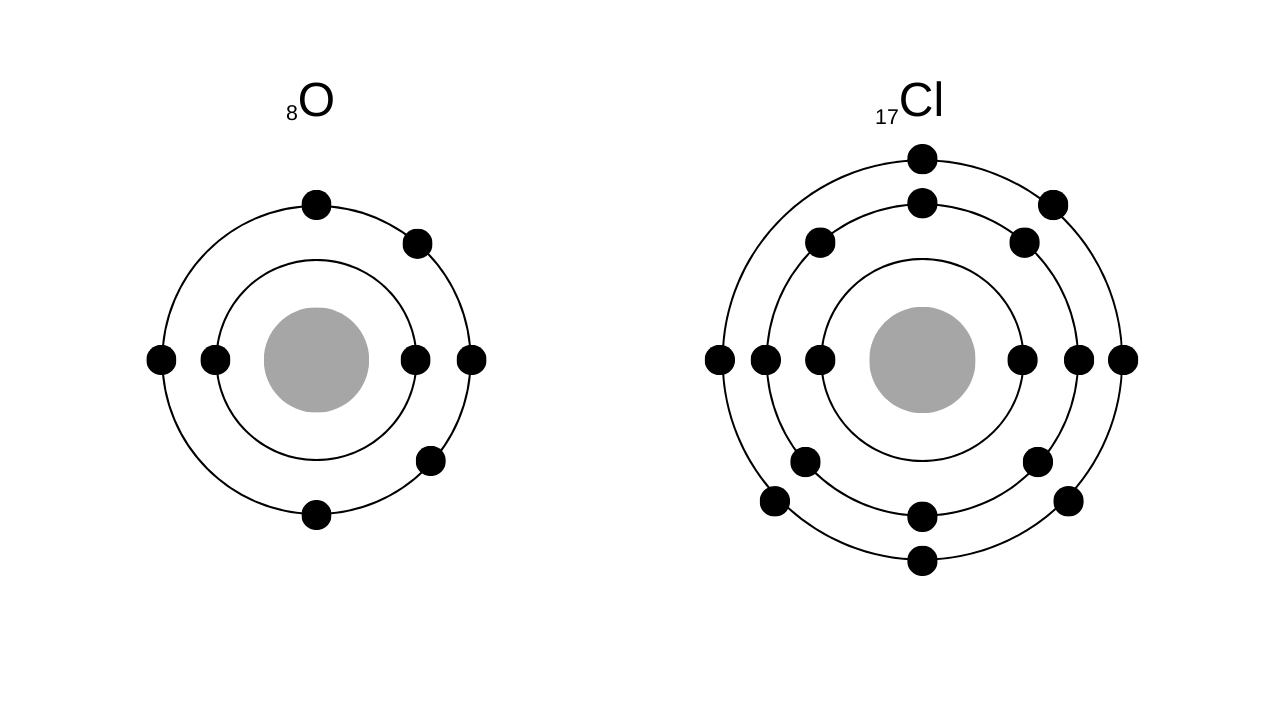
- (4) \(\mathrm{_8O}\)および\(\mathrm{_{17}Cl}\)について、その電子配置を図にならって示せ。
-
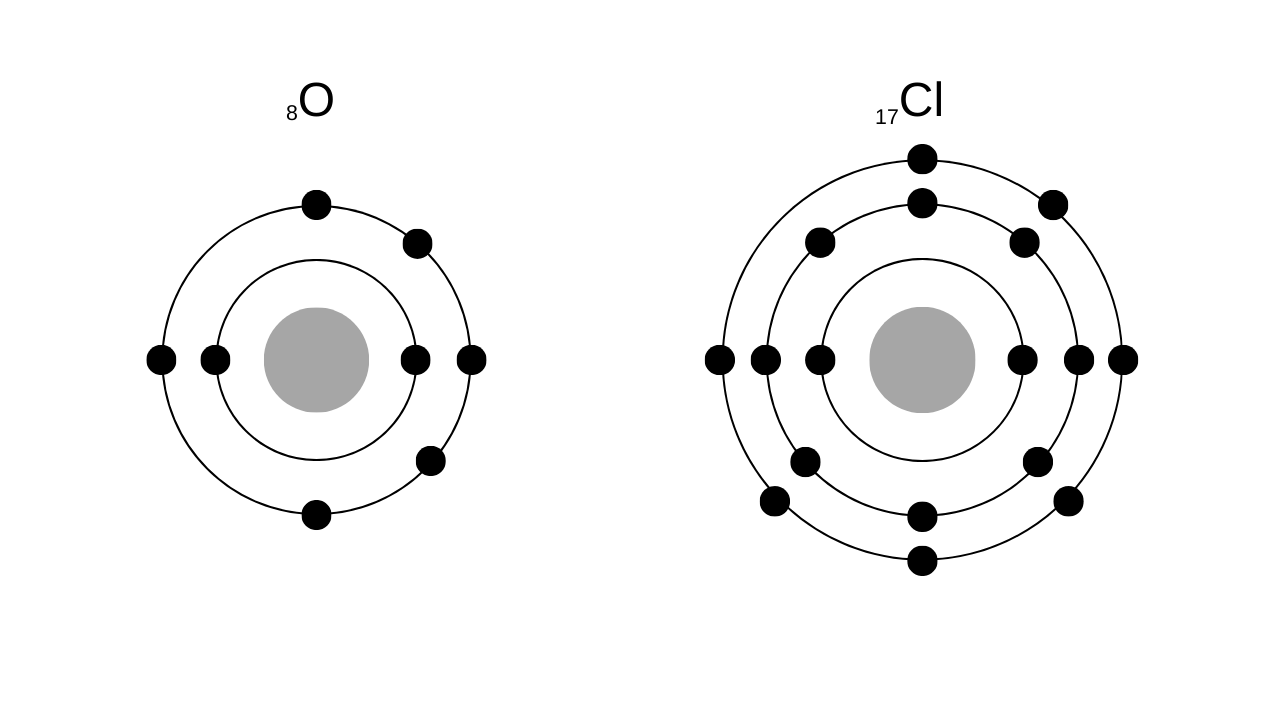
\(\mathrm{_8O}\)は8個の電子を持つので、K2, L6となります。
\(\mathrm{_{17}Cl}\)は17個の電子を持つので、K2, L8, M7となります。
それぞれ電子配置を図示すると以下のようになります。

まとめ
今回は、原子の電子配置について解説しました。
原子の電子配置は原子の構成が理解できている前提の内容です。
原子の構成については下記記事で詳しく解説しているので、是非チェックしてみてください!


本記事のチェックリストを以下にまとめました。ぜひ復習に役立ててください!
- 電子殻とはなにか?
- 電子配置とはなにか?
- 価電子=最外殻電子は常に成り立つか?
- 貴ガスはなぜ安定なのか?
下記SNSにて、情報発信&質問対応を行っています。
質問については、本サイト内の内容に限らず勉強の相談等なんでもOKです。
本サイト運営者のかんたが直接お答えしております。お気軽にお問い合わせください!
X(旧Twitter)
LINE
Instagram
YouTube


質問・コメント