元素の周期律とグラフ
 悩む人
悩む人元素の周期律がグラフになると分かりづらい…
このような悩みで手が止まっていませんか?
元素の周期律はグラフになるとどれがどれだかごちゃごちゃしてしまいます。
しかし、元素の周期律はたった4つに分けて説明することができるのです。
そこで、今回は
元素の周期律について、グラフ4つと実践問題を通してわかりやすく解説していきます!
本記事は以下のような人におすすめです!
- 元素の周期律がよく分からない。
- 元素の周期律のグラフ問題が解けない。



この記事を読んで、グラフを見てパッと何を表しているか答えられるようになろう!
問題
次のグラフは、原子番号1~20の元素の性質を示す数や量を表したものである。(ア)~(ウ)Ⅱ該当するものを選択軍の中から選び、番号で記せ。(左から(ア)、(イ)、(ウ))
(ア) (イ) (ウ) ①電子の数、②価電子の数、③原子半径、④第1イオン化エネルギー
2020セミナー化学基礎 | 第一学習社
上の3つの図の拡大版↓
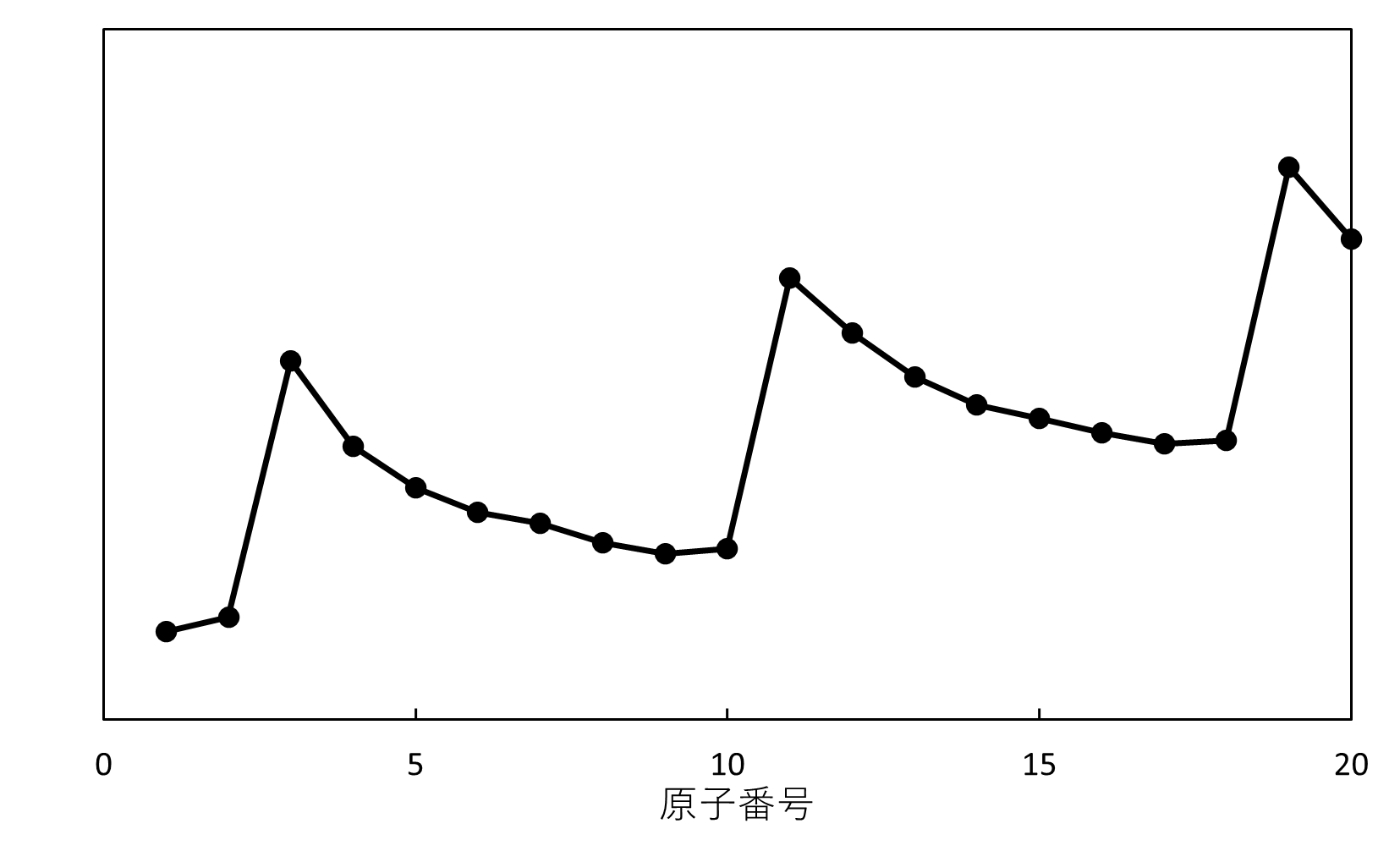

(ア)
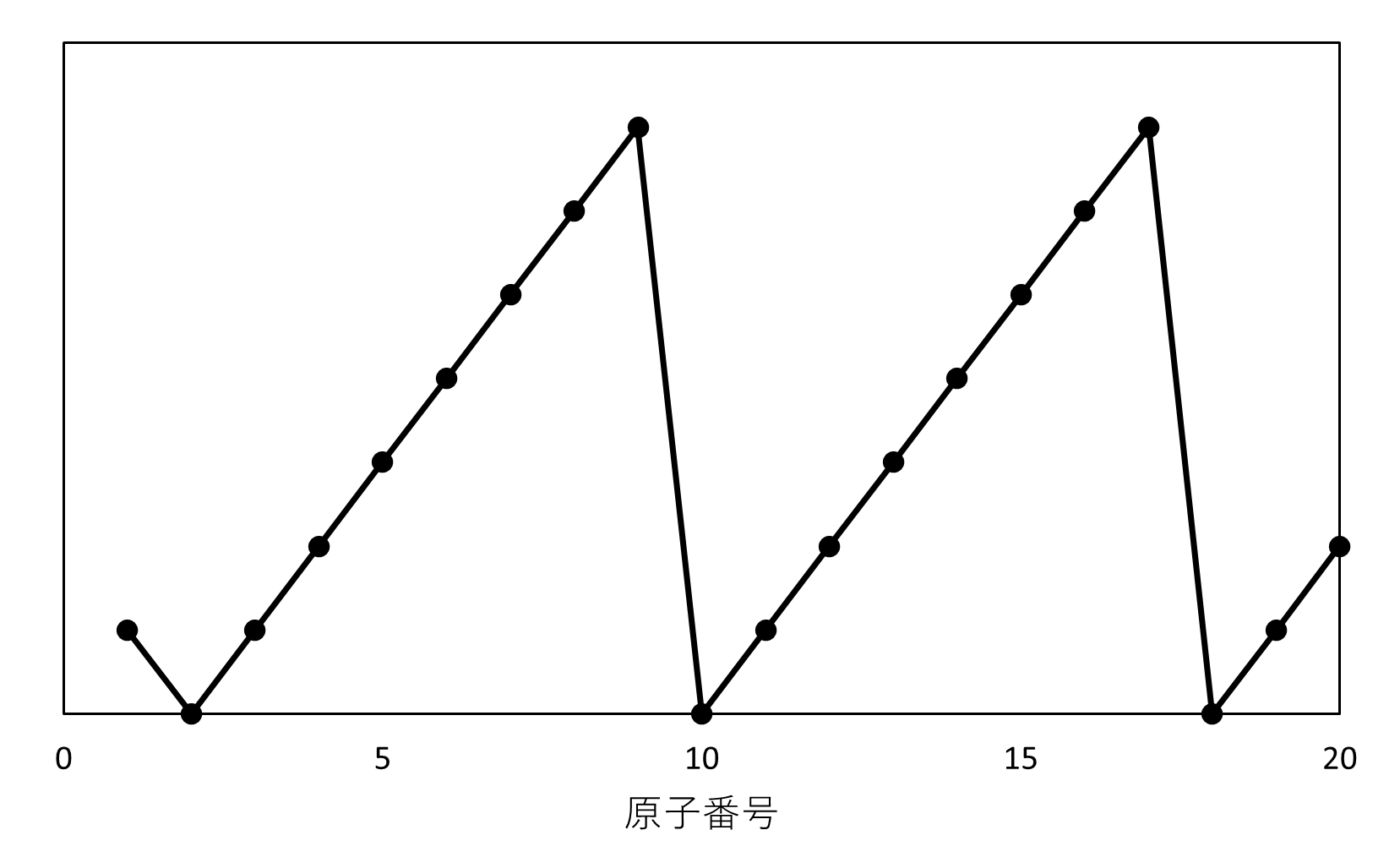

(イ)
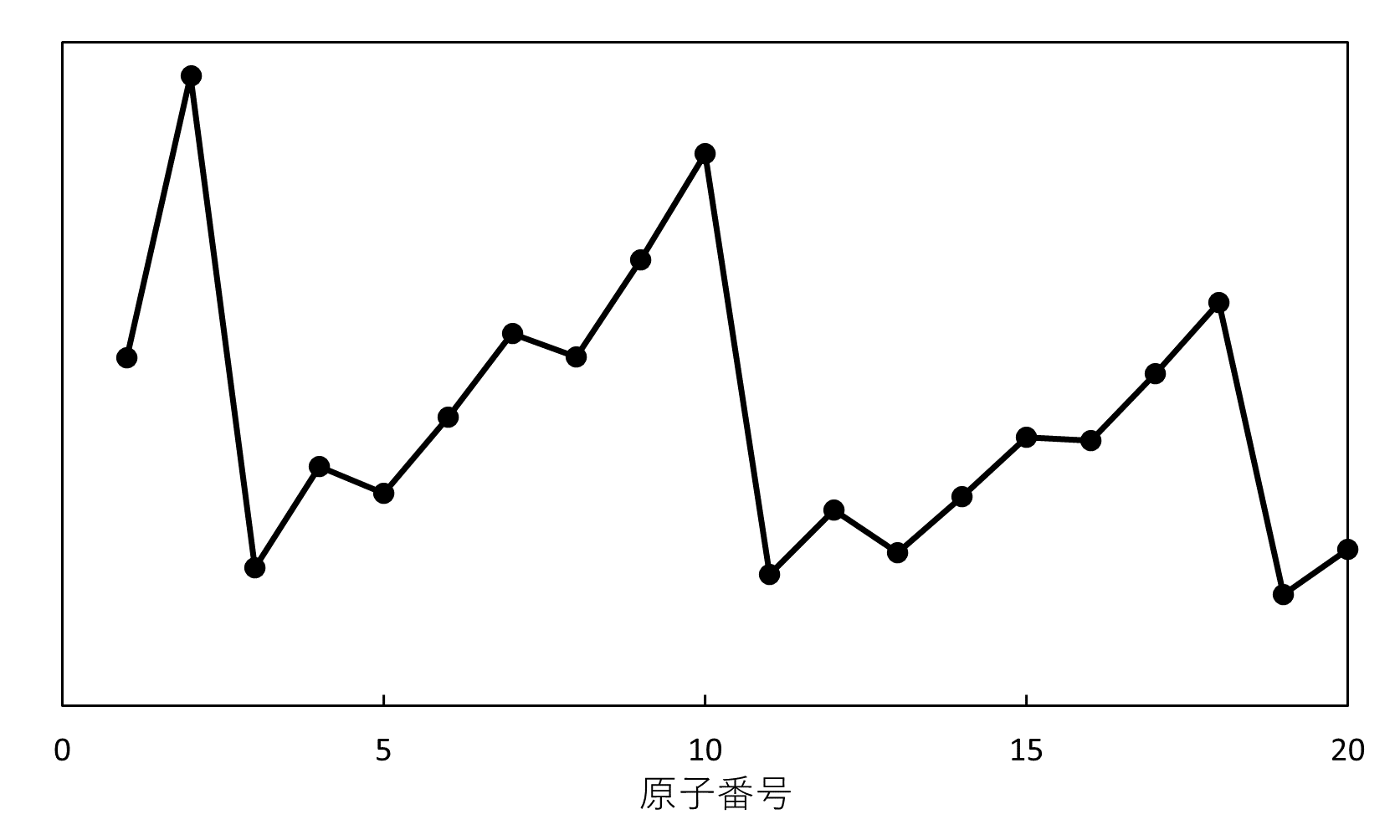

(ウ)
略解
(ア) ③
(イ) ②
(ウ) ④
テキスト:元素の周期律
それでは、この問題に必要な知識・ポイントを確認していきましょう。
「元素の周期律」とは
まず、元素の周期律とは何かについて説明します。
元素の周期表は、元素を原子番号順に並べたもので、その並びにはそれぞれ似た性質があることがわかっています。
その似た性質は、周期的に変化していることがわかっています。
元素の性質のこのような周期性を、「元素の周期律」といいます。
この周期律ですが、大きく分けて4つに分類できます。
今回は、この4つの分類についてわかりやすく解説していきます。
①価電子数と周期律
まず、価電子数と周期律は次のようなグラフで表されます。
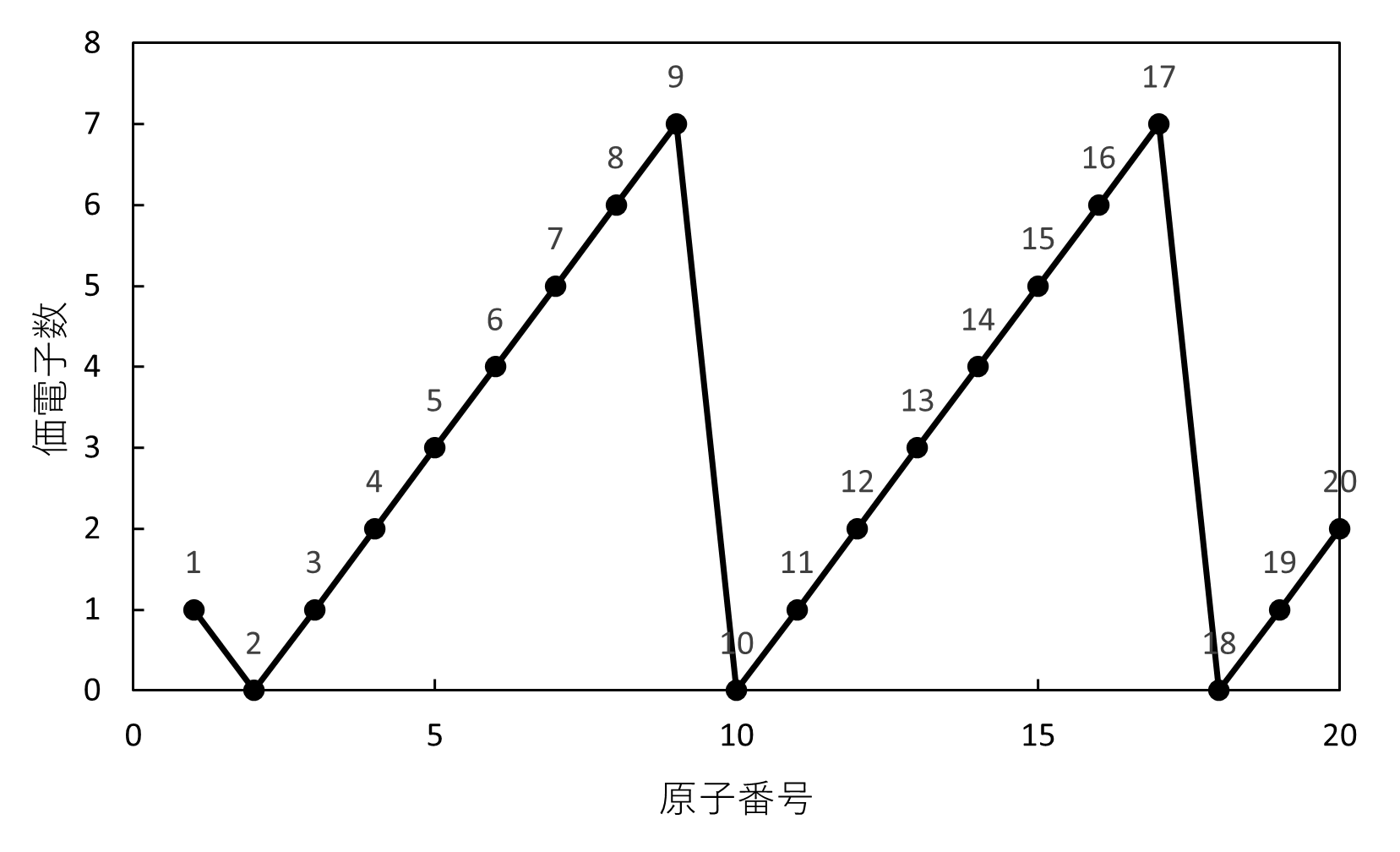




なんでこんなグラフになるかが分からない…
では、なぜこのようなグラフになるのか丁寧に解説していきます。
まず、「価電子」の定義についておさらいしましょう。
価電子について詳しく知りたい人は、下記記事をチェックしてみてください!
では、この価電子がどのような周期性を示すのでしょう?
価電子は、以下の2つが常に成り立ちます。
- 同周期では、原子番号の増加とともに価電子も増加する。
- 貴ガスの価電子は常にゼロである。
これらの特徴を第二周期の元素を例に確認してみましょう。
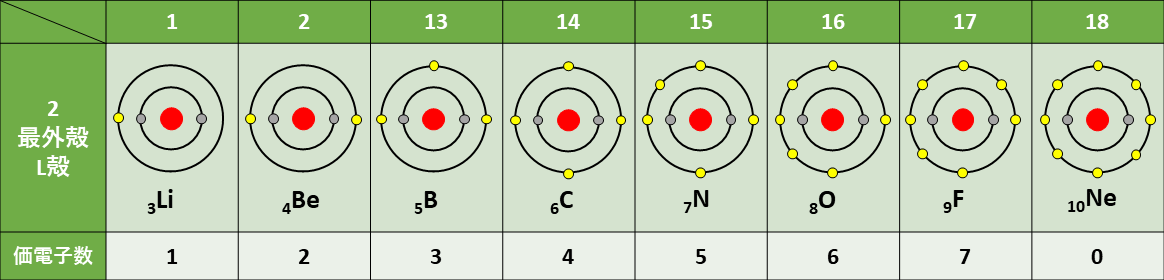

第二周期の元素の電子配置は上記のようになります。
●が陽子、その他の小さい丸は電子を表しています。
電子の中でも黄色で表したものは最外殻電子=価電子です。
このように、原子番号が増えるほど価電子の数が増えていることがわかります。



貴ガスの価電子が0であることに注意!
つまり、これを言葉にすると次のように表せます。
価電子数は、同周期では原子番号の増加とともに増え、貴ガスでは0となる。同族では常に同じ値を示す。
さて、ではこれを踏まえて最初のグラフを確認してみましょう。
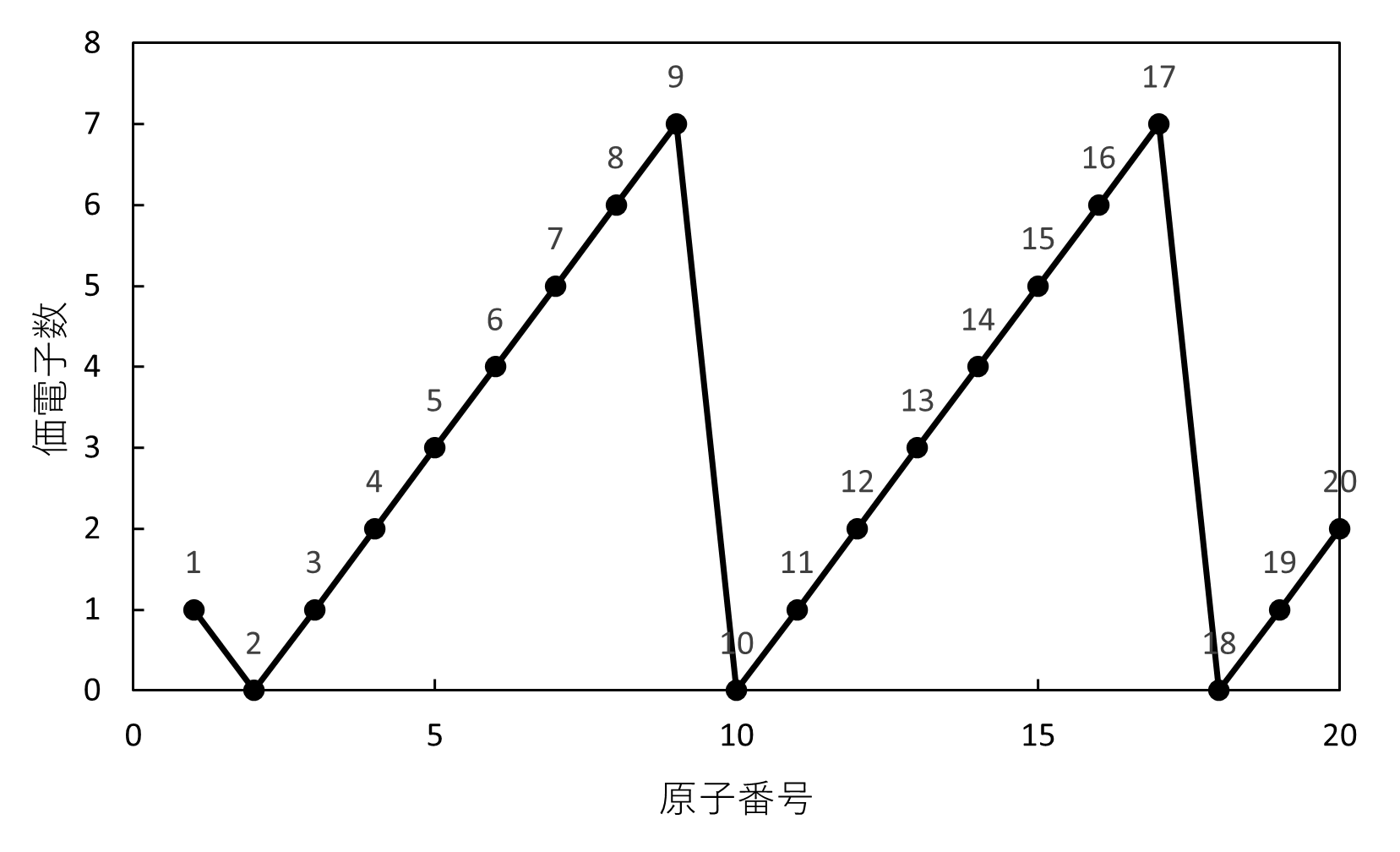

横軸に原子番号、縦軸に価電子数をとると、同周期で価電子数は増え、貴ガスで0になっています。
②原子半径と周期律
次に、原子半径と周期律の関係について説明します。
まず、原子半径と周期律の関係のグラフから見てみましょう。
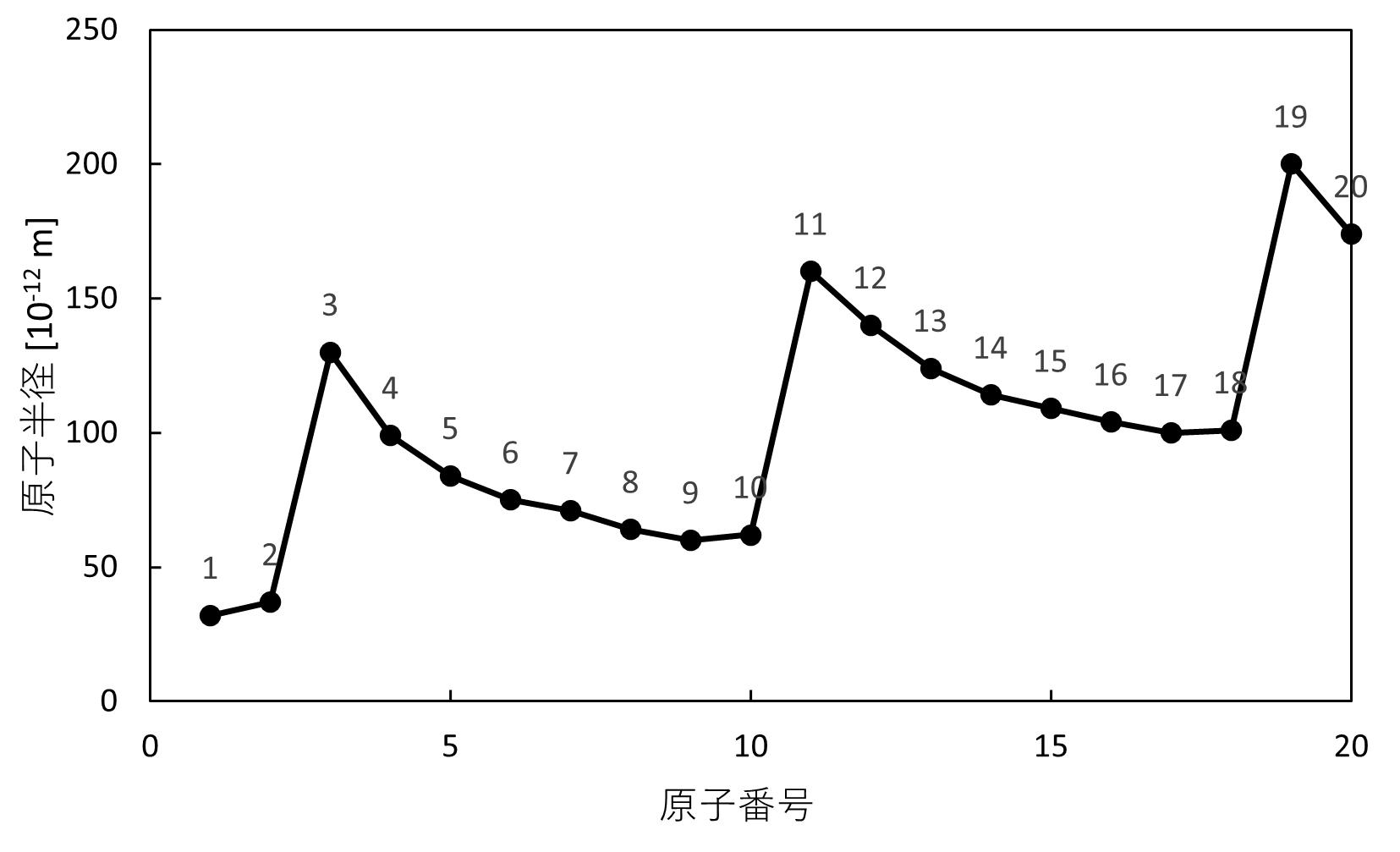

このようなグラフになる理由を1つ1つ考えていきましょう。
原子半径とは、その名の通り原子の半径のことをいいます。
原子半径は、一般に以下の2点が成立します。
- 同周期では、原子番号が大きくなるほど原子半径は小さくなる(18族は除く)。
- 同族 では、原子番号が大きくなるほど原子半径は大きくなる。
この2つの特徴について説明します。
- ①同周期では、原子番号が大きくなるほど原子半径は小さくなる(18族は除く)。
-
原子核の陽子(正電荷)はプラスに帯電していて、電子はマイナスに帯電しているため、陽子と電子はプラスとマイナスで引き合っています。

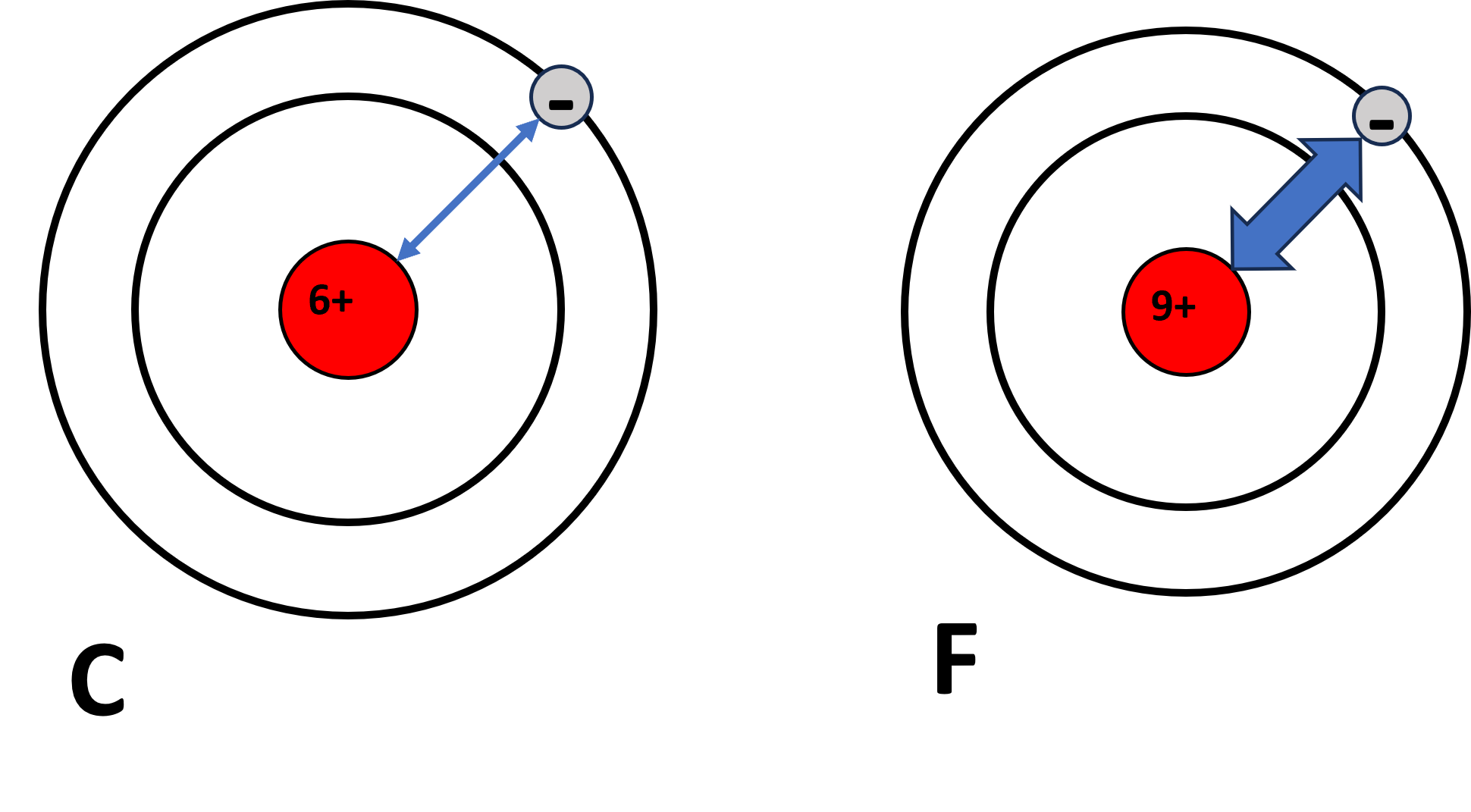
すると、陽子(正電荷)が多いほうが電子がより中心付近に引き寄せられるため、原子半径は小さくなることが容易に想像できます。
上の図のように、同周期の炭素\(\mathrm{C}\)とフッ素\(\mathrm{F}\)を比較してみても、フッ素の方が外側の電子が中心付近にギュッと引き寄せられて原子半径が小さくなることがイメージできると思います。



18族だけ例外なのはなぜ?
それは、電子同士の反発が理由です。

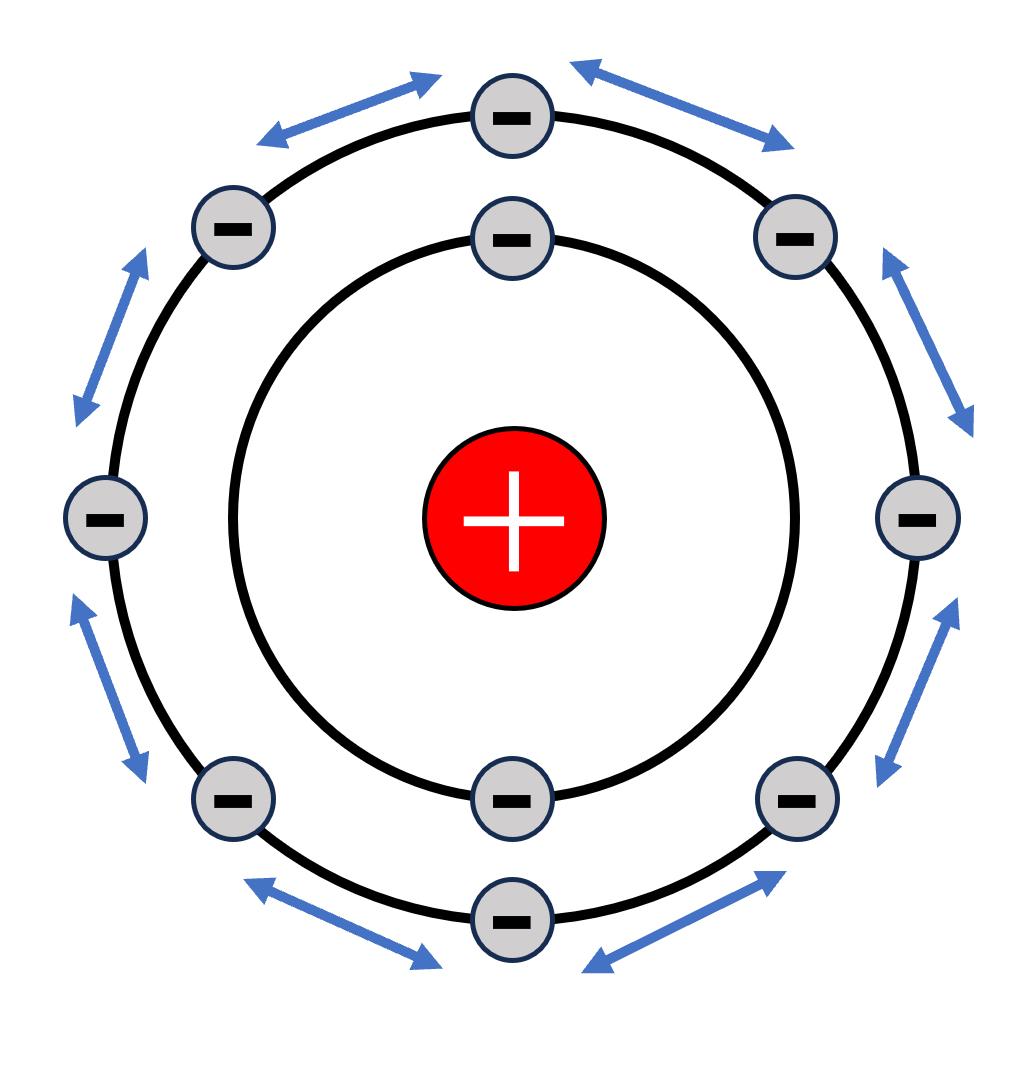
原子番号10番のネオン\(\mathrm{Ne}\)を例に考えてみましょう。
ネオンは、18族の貴ガスで、最外殻電子を8個持っています。
このとき、電子同士の距離が近いので、右の図のように電子同士がそれぞれ反発してしまいます。
その反発による力が正電荷が電子を引き寄せる力よりも大きいため、最外殻電子が広がって結果的に原子半径が大きくなります。
このことから18族の元素は例外といえます。
- ②同族では、原子番号が大きくなるほど原子半径は大きくなる。
-
同族で比較すると、原子番号が大きくなるに連れて原子半径が大きくなることは容易に想像できると思います。

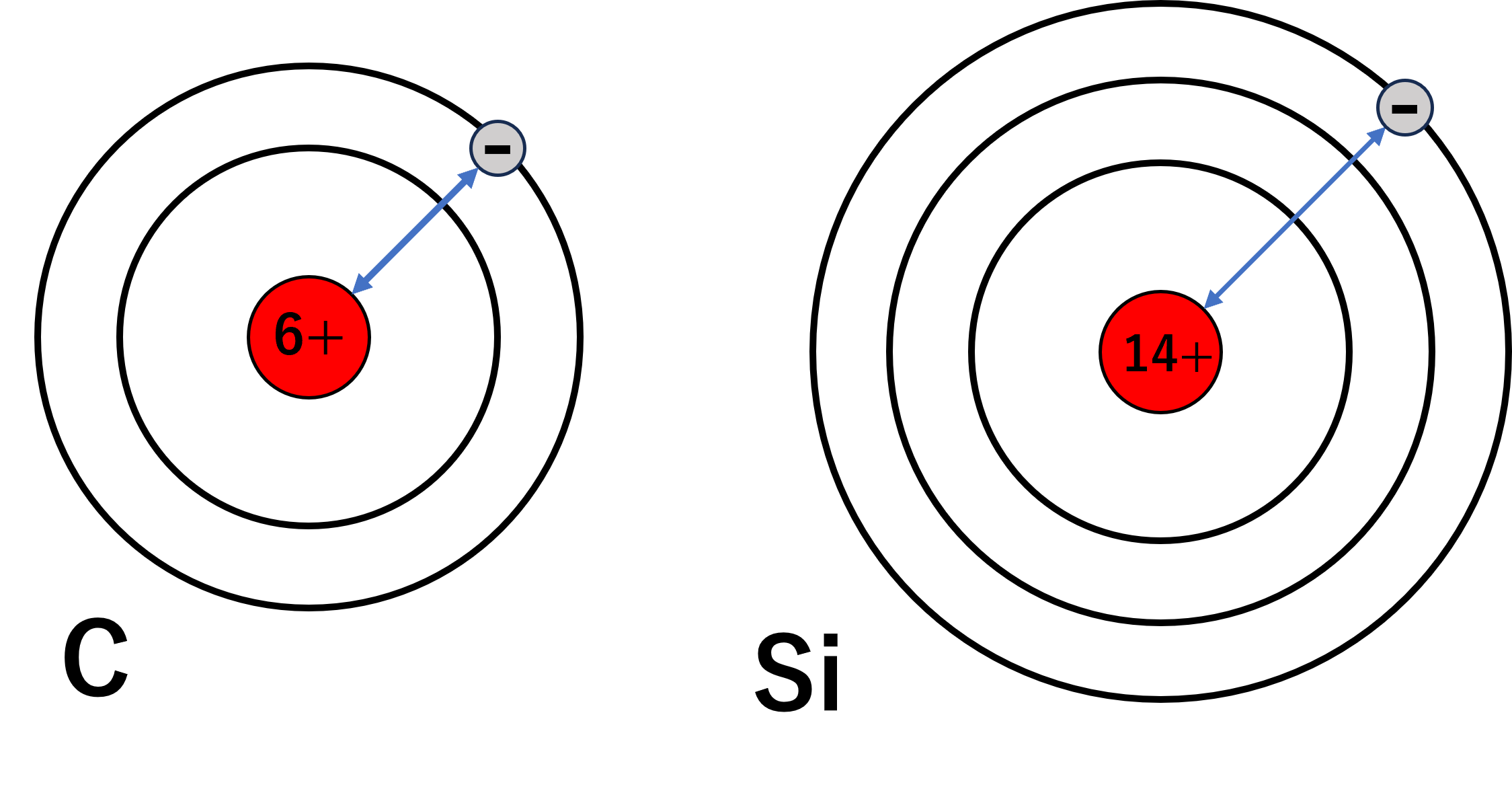
炭素\(\mathrm{C}\)とケイ素\(\mathrm{Si}\)はどちらも14族の元素ですが、ケイ素のほうが電子殻が1つ多いので、ぱっと見で原子半径が大きいことがわかります。
よって、同族では、原子番号が大きいものほど原子半径が大きくなります。
上記の2点を踏まえると、次のようにいえます。
原子半径は、同周期では、18族を除き原子番号が大きくなるほど小さくなり、同族では、原子番号が大きくなるほど大きくなる。
では、最初のグラフに戻って確認してみましょう。
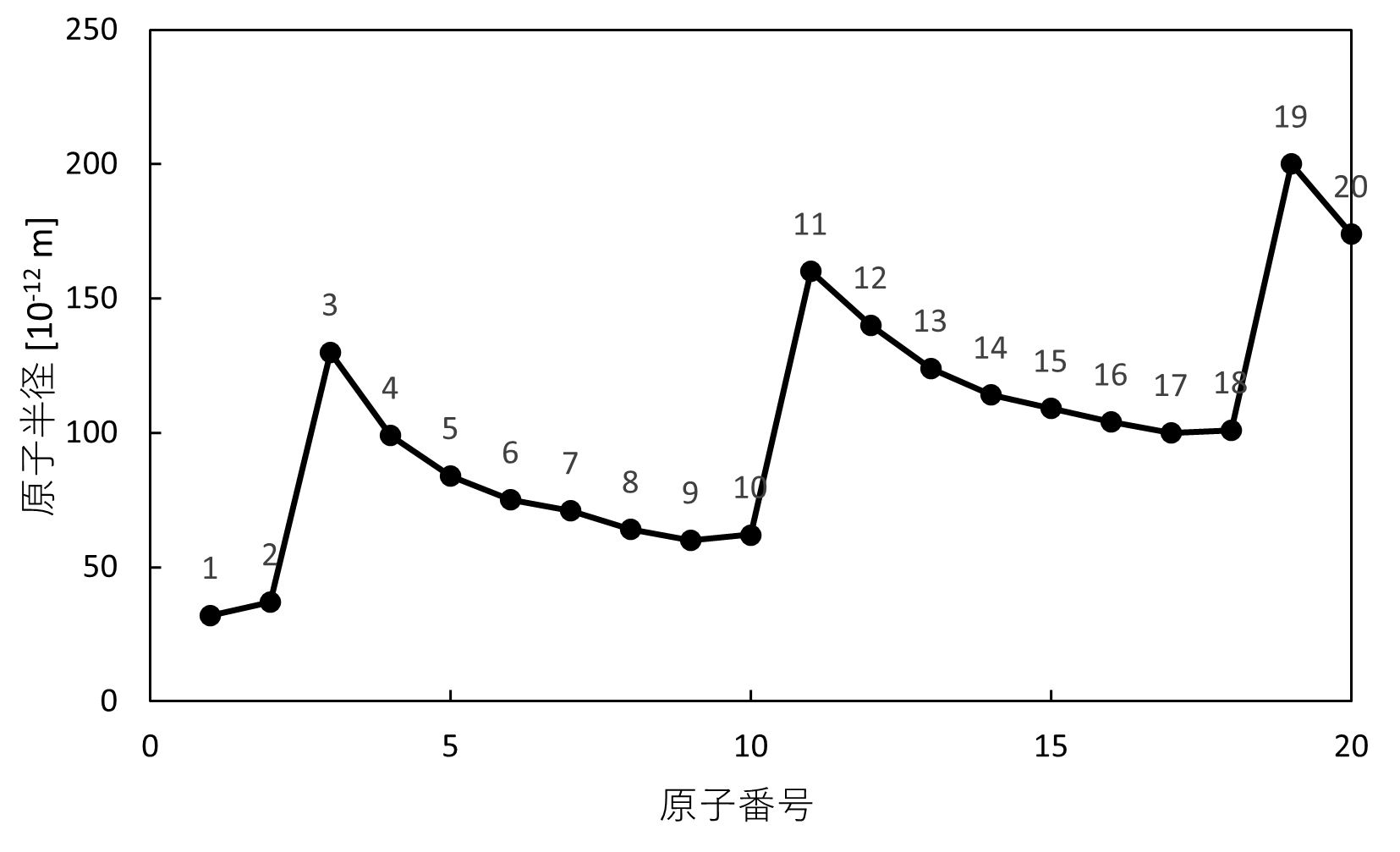

横軸に原子番号、縦軸に原子半径をとると、同周期では徐々に低下し貴ガスで最大、同族では大きくなっていることがわかります。
③イオン化エネルギーと周期律
最後に、イオン化エネルギーと周期律の関係について説明します。
まず、イオン化エネルギー(※)とは何かについて説明します。
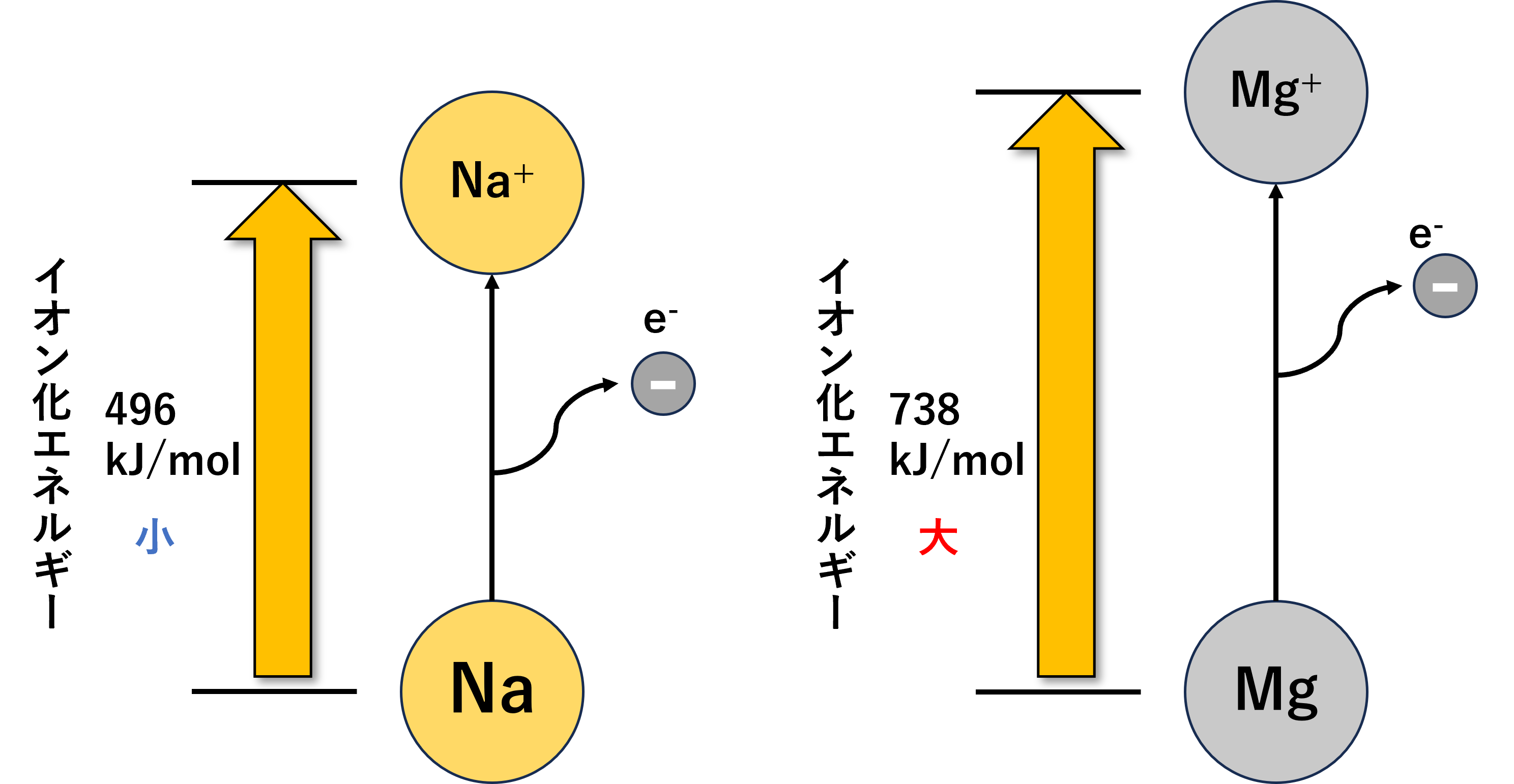

上の図を例に考えてみましょう。
\(\mathrm{Na}\)原子のイオン化エネルギーは\(\mathrm{496 \; [kJ/mol]}\)です。
\(\mathrm{Mg}\)原子のイオン化エネルギーは\(\mathrm{738 \; [kJ/mol]}\)です。
よって、この2つを比べると\(\mathrm{Mg}\)原子のほうがイオン化エネルギーが大きいといえます。
(※)
原子から1個の電子を取り去るの要するエネルギーを、厳密には第一イオン化エネルギーと言います。更に、2個目、3個目の電子を取り去るのに要するエネルギーを、それぞれ、第2、第3イオン化エネルギーといいます。
では、このイオン化エネルギーを周期表の配列と比較するとどのような特徴が見えてくるのでしょうか?
まず、実際のグラフを確認します。
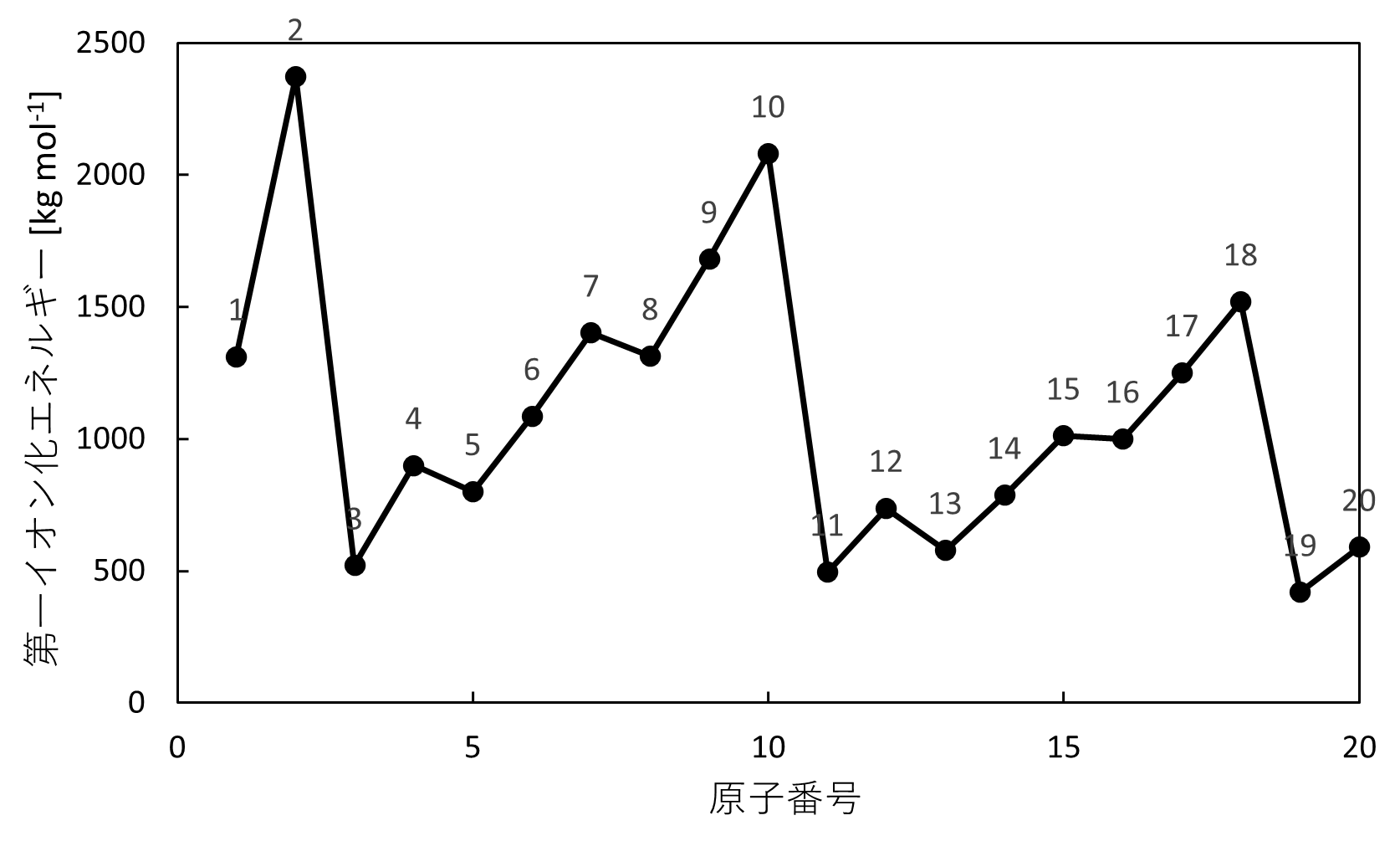

このようなグラフになる理由を解説します。
イオン化エネルギーは、大きく分けて2つの特徴があります。
- 同周期では、イオン化エネルギーは原子番号とともに増加傾向にある。
- 次の周期に移ると、イオン化エネルギーは急激に低下する。
この2つについて、具体例を用いて説明していきます。
- ①同周期では、イオン化エネルギーは原子番号とともに増加傾向にある。
-
まず、原子核の陽子(正電荷)はプラスに帯電していて、電子はマイナスに帯電しているため、陽子と電子はプラスとマイナスで引き合っています。
よって、同周期では、
原子番号が大きい→陽子(正電荷)が多い→電子が強く引きつけられる→イオン化エネルギーが大きい
となります。言葉で説明されてもピンとこないと思うので、具体例を見ていきましょう。

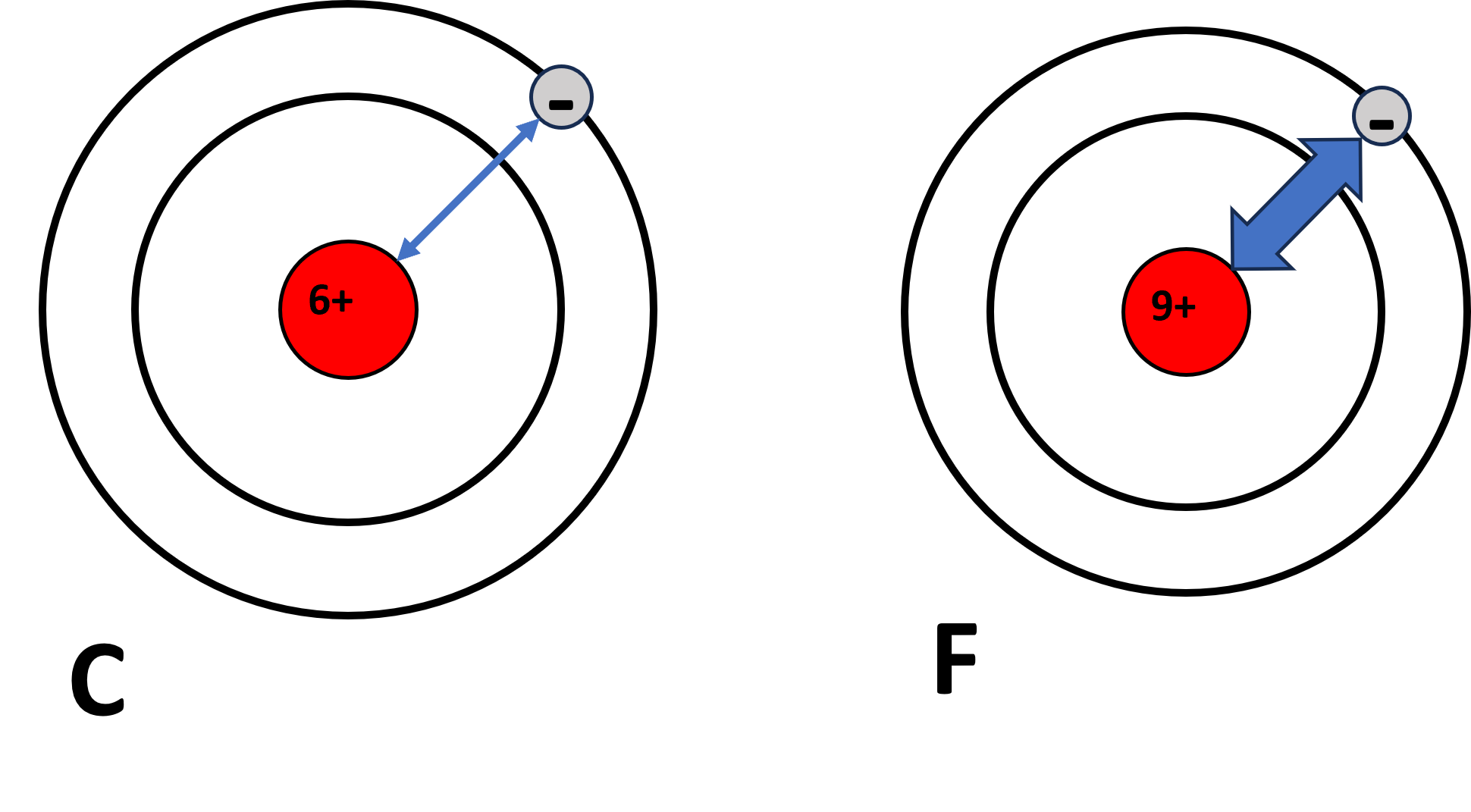
例として、同周期の炭素\(\mathrm{C}\)とフッ素\(\mathrm{F}\)を比較してみましょう。
炭素は、原子番号6で+6の力で電子を引き寄せています。
フッ素は、原子番号9で+9の力で電子を引き寄せています。
当然+9のフッ素のほうが電子を強く引き寄せるので、電子を1個取り去るのに必要なエネルギー(イオン化エネルギー)は大きくなります。
よって、原子番号の大きいフッ素のほうがイオン化エネルギーが大きくなるのです。
- ②次の周期に移ると、イオン化エネルギーは急激に低下する。
-
次の周期に移ると、電子殻が1つ増えることになります。
すると、陽子(正電荷)と電子の距離が長くなるため、引き合う力は急激に低下してしまいます。
つまり、
次の周期に移る→陽子(正電荷)と電子の距離が長くなる→電子が引きつけられる力が弱くなる→イオン化エネルギーが小さい
となるのです。
これも、具体例を見て理解していきましょう。

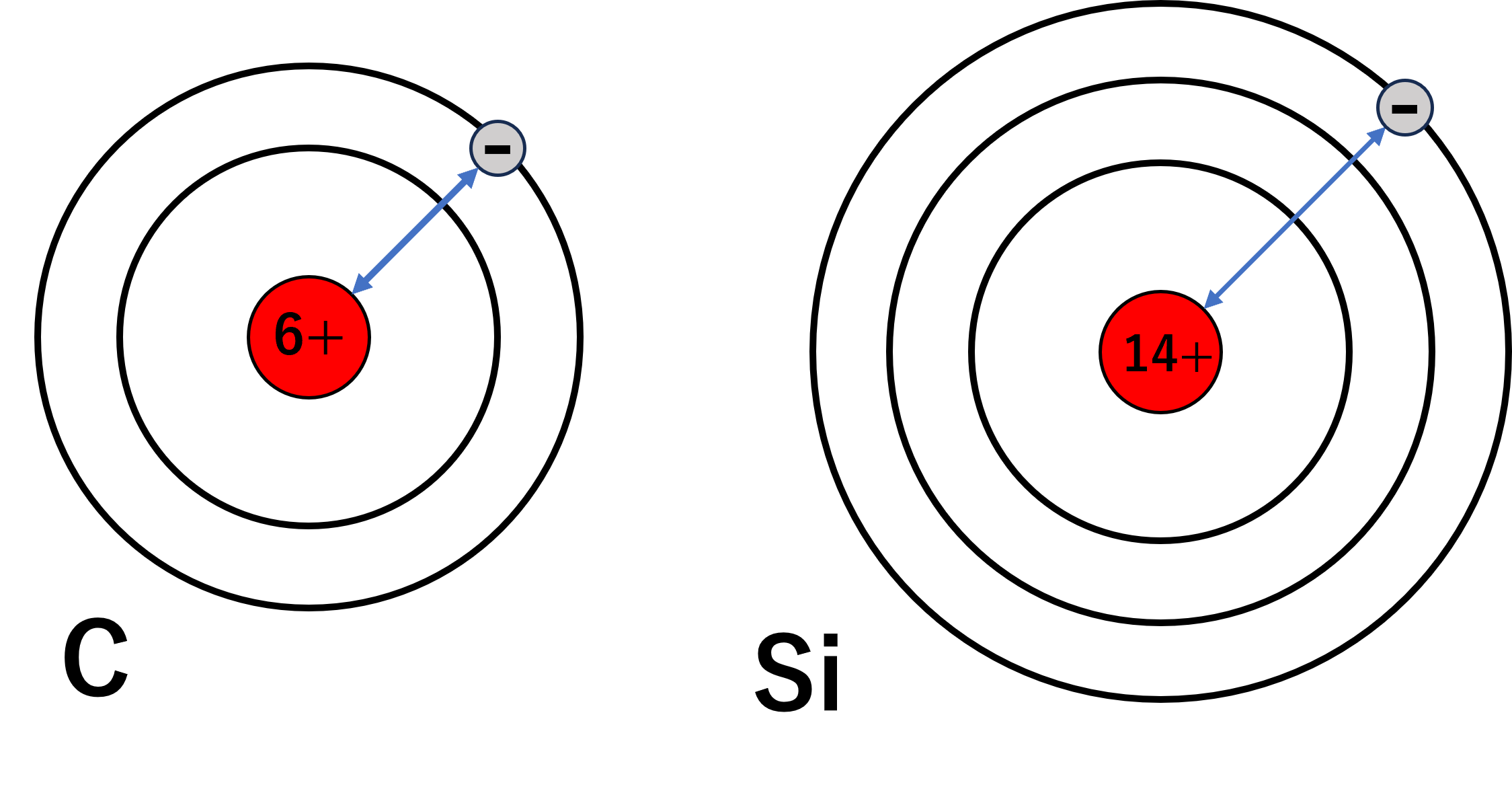
炭素\(\mathrm{C}\)は第2周期で、ケイ素\(\mathrm{Si}\)は第3周期です。
図からもわかる通り、明らかに陽子(正電荷)と電子の距離が長くなっています。
この場合、中心の正電荷の大きさに関係なく、距離の影響により陽子が電子を引き寄せる力が弱まり、電子1個を取り去るのに必要なエネルギー(イオン化エネルギー)は小さくなります。
よって、次の周期のケイ素\(\mathrm{Si}\)のほうがイオン化エネルギーは小さくなる。



陽子と電子の距離による影響は大きいんだね!
上記の2点を踏まえると、次のようなことがいえます。
イオン化エネルギーは、同周期では原子番号の増加とともに大きくなり、次の周期に移ると急激に低下する。
では、再度グラフを確認してみましょう。
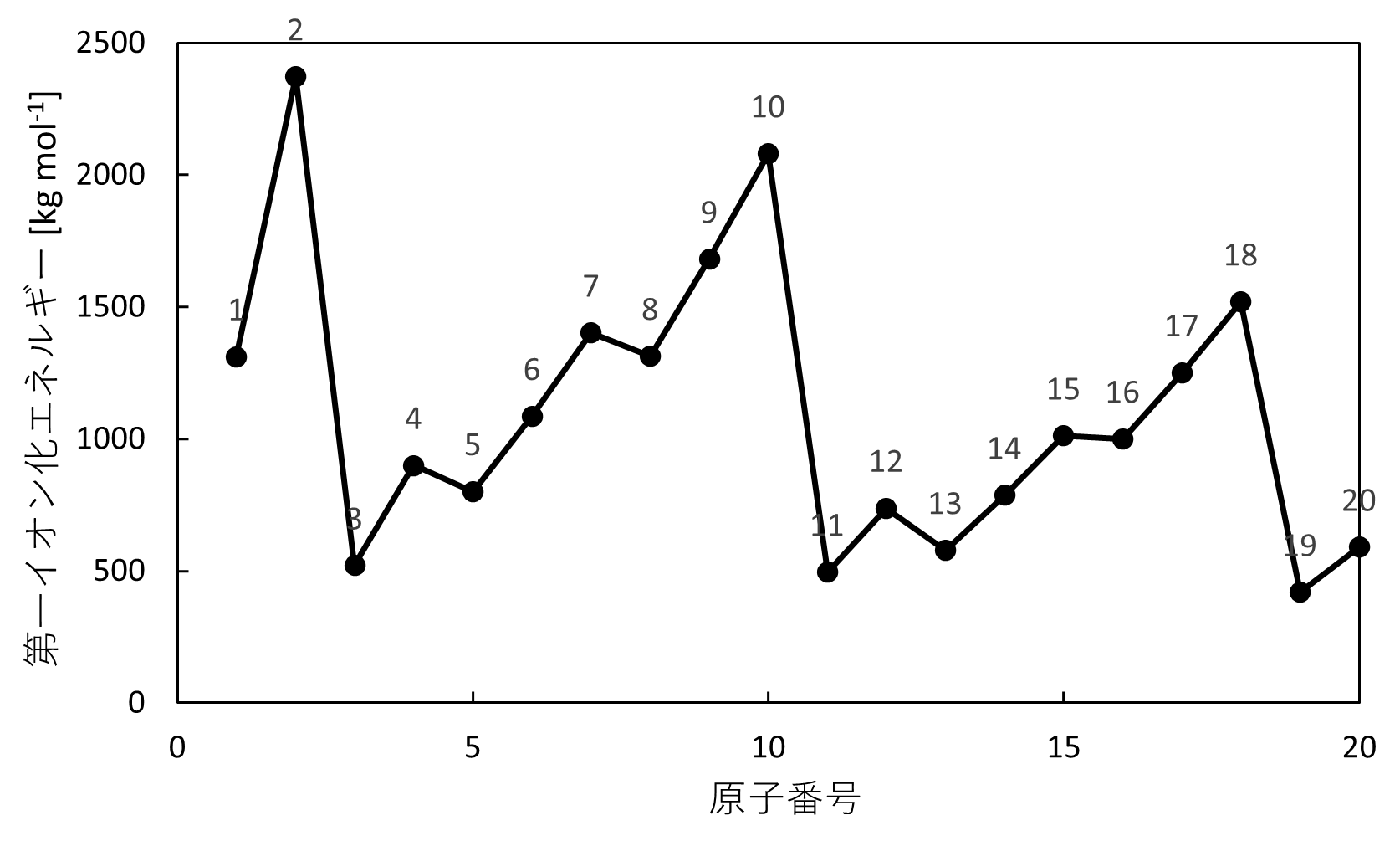

横軸に原子番号、縦軸にイオン化エネルギーをとると、
確かに、同族では原子番号の増加とともにイオン化エネルギーが大きくなり、同周期では原子番号ば大きい方が大幅にイオン化エネルギーが小さいことがわかります。
④イオン半径と周期律
最後に、イオン半径についても考えてみましょう。
イオン半径は同じ電子配置を持つイオン同士で比較することが主です。
同族で比較したとしても、原子半径と同じく原子番号が大きいほど電子殻が増えるため大きくなります。
では、同周期ではどの様になるのでしょうか?
イオン半径には以下のような特徴があります。
- 同じ電子配置を持つイオン半径は、原子番号が大きくなるほど小さくなる。
なぜこの様になるのか、説明します。
- ・同じ電子配置を持つイオン半径は、原子番号が大きくなるほど小さくなる。
-
イオンは、電子をもらいマイナスに帯電する陰イオンと、電子を放出しプラスに帯電する陽イオンがあります。
ここで、
- 単原子の陽イオン半径は、もとの原子の半径よりも小さくなる。
- 単原子の陰イオン半径は、もとの原子の半径よりも大きくなる。
-
という性質があります。
具体例を考えてみましょう。
\(\mathrm{O^{2-} , \, F^- , \, Na^+ , \, Mg^{2+} , \, Al^{3+}}\)は、\(\mathrm{Ne}\)原子と同じ電子配置を持つイオンです。

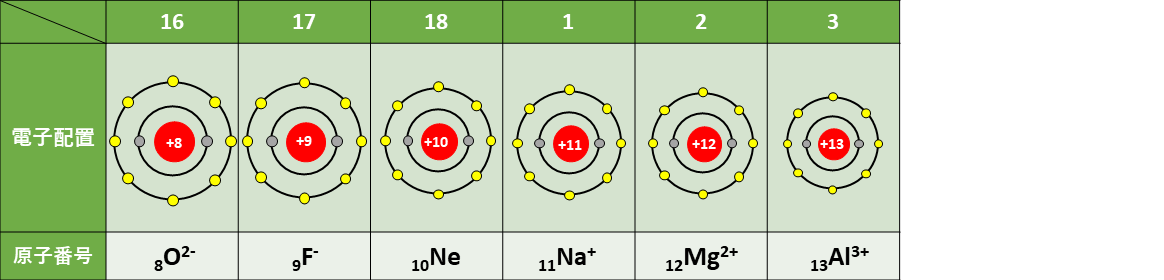
よって、イオン半径は陽子の数によって変わってきます。
原子番号が大きい→陽子(正電荷)が多い→電子が強く引きつけられる→イオン半径が小さくなる
となります。



イオン化エネルギーのときと同じように考えることができるね!
これを踏まえると、次のように説明できます。
同じ電子配置を持つイオン半径は、原子番号が大きくなるほど小さくなる。
これらを踏まえて、問題の解説を確認していきましょう。
解説
次のグラフは、原子番号1~20の元素の性質を示す数や量を表したものである。(ア)~(ウ)Ⅱ該当するものを選択軍の中から選び、番号で記せ。(左から(ア)、(イ)、(ウ))
(ア) (イ) (ウ) ①電子の数、②価電子の数、③原子半径、④第1イオン化エネルギー
2020セミナー化学基礎 | 第一学習社
原子番号と周期律の関係については、必ずと言っていいほど「同族」または「同周期」に何らかの関係性が見られます。
なので、同族、同周期でどのような特徴があるかを確認することが大切です。
- (ア)
-
同族では、原子番号が増えるに連れて、大きくなっている。
同周期では、原子番号が大きくなるに連れて、小さくなっている。
このような特徴を表すのは、③原子半径です。
A. ③
- (イ)
-
同族では、常に同じ値を示している。
同周期では、原子番号が増えるに連れて、均等に増えている。
このような特徴を表すのは、②価電子の数です。
A. ②
- (ウ)
-
同族では、原子番号が増えるに連れて、おおむね小さくなっている。
同周期では、原子番号が増えるに連れて、おおむね大きくなっている。
このような特等を表すのは、④第1イオン化エネルギーです。
A. ④
まとめ
今回は、元素の周期律について解説してきました。
元素の周期律は原子の構造や電子配置と大きく関係します。
原子の構造や電子配置については下記記事で詳しく解説しているので、是非チェックしてみてください!
本記事の重要事項を以下にまとめました。ぜひ復習に役立ててください!
- 元素の周期律とはなにか?
- 価電子数の周期律とは?
- 原子半径の周期律とは?
- イオン化エネルギーの周期律とは?
- イオン半径の周期律とは?
下記SNSにて、情報発信&質問対応を行っています。
質問については、本サイト内の内容に限らず勉強の相談等なんでもOKです。
本サイト運営者のかんたが直接お答えしております。お気軽にお問い合わせください!
X(旧Twitter)
LINE
Instagram
YouTube


質問・コメント