構造式を決定する手順は?
未知の有機化合物を含む混合物から構造式の決定を行うまでのプロセスは次の5ステップなります。
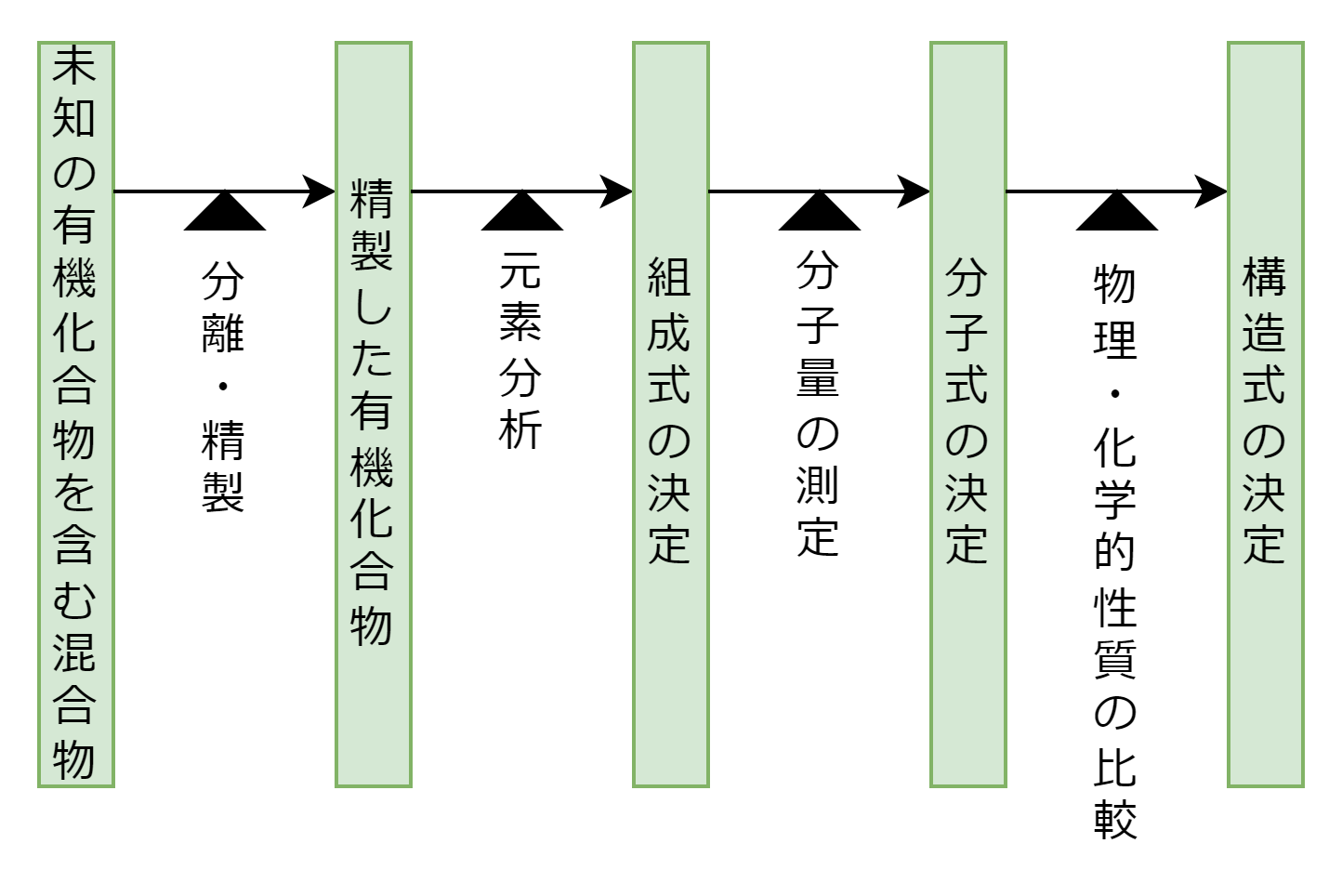
混合物から特定の有機化合物を分離・精製する方法は、蒸留・抽出・カラムクロマトグラフィー・ガスクロマトグラフィーなどがあります。
これらの方法については下記記事で詳しく解説しているのでぜひご参照ください。

今回は、元素分析と分子量の測定の行程について演習問題を通して解説していきます!
本記事は以下のような人におすすめです!
- 元素分析の方法について知りたい
- 組成式・分子式の決定方法がよくわからない
元素分析と分子量測定について攻略しましょう!
問題1:元素分析
図は、元素分析装置を模式的に示したものである。炭素と水素からなる化合物10.5 mgを完全燃焼させたところ、水18.9 mgと二酸化炭素30.8 mgを得た。
(1) 酸化銅(Ⅱ)はどのような役割をしているか。
2021セミナー化学 | 第一学習社
(2) 塩化カルシウム管とソーダ石灰管は、それぞれどのような役割をしているか。
(3) 塩化カルシウム管とソーダ石灰管の順番を逆にしてはいけないのはなぜか。
(4) 元素分析の結果から、化合物中の炭素原子と水素原子の質量パーセントを求めよ。
略解
(1) 試料の不完全燃焼によって生じた一酸化炭素を酸化して、二酸化炭素にする。
(2)
塩化カルシウム管:試料の燃焼によって生じた水蒸気を吸収する。
ソーダ石灰管:二酸化炭素を吸収する。
(3) ソーダ石灰は二酸化炭素と水蒸気の療法を吸収するため、順番を逆にすると、ソーダ石灰管で二酸化炭素と水蒸気の両方が吸収されてしまい、それぞれの質量を測定できなくなるから。
(4) 炭素原子:80.0%、水素原子:20.0%
テキスト1:元素分析
まず、有機化合物に含まれる成分元素がどのようにして検出されるかを確認しましょう。
| 成分元素 | 操作 | 生成物 | 検出方法の例 |
|---|---|---|---|
| 炭素 | 酸素気流中で酸化銅(Ⅱ)と熱する | 二酸化炭素\(\mathrm{CO_2}\) | ・石灰水により白色沈殿を生じる |
| 水素 | 同上 | 水 \(\mathrm{H_2O}\) | ・硫酸銅(Ⅱ)無水物を青変させる ・塩化コバルト紙を赤変させる |
| 窒素 | 水酸化ナトリウムとともに加熱する | アンモニア\(\mathrm{NH_3}\) | ・濃塩酸を近づけると白煙を生じる ・赤色リトマス紙を青変する |
| 硫黄 | ナトリウムや水酸化ナトリウムとともに加熱した後、水に溶かす | 硫化ナトリウム\(\mathrm{Na_2S}\) | ・酢酸酸性下、酢酸鉛(Ⅱ)水溶液により黒色沈殿を生じる |
| 塩素 | 熱した銅線につけて赤熱する | 塩化銅(Ⅱ)\(\mathrm{CuCl_2}\) | ・炎色反応(青緑色)が見られる |
特に注目すべき点は、
- 炭素\(\mathrm{C}\)は酸素気流中で酸化銅(Ⅱ)と熱することで二酸化炭素\(\mathrm{CO_2}\)を生じる
- 水素\(\mathrm{H}\)も同様にして水\(\mathrm{H_2O}\)を生じる
という点です。この2つは、以下の元素分析の実験装置でも利用します。
では、有機化合物の定量的な元素分析の方法について確認しましょう。
まず、元素分析をする際に使用される実験装置を下に示します。
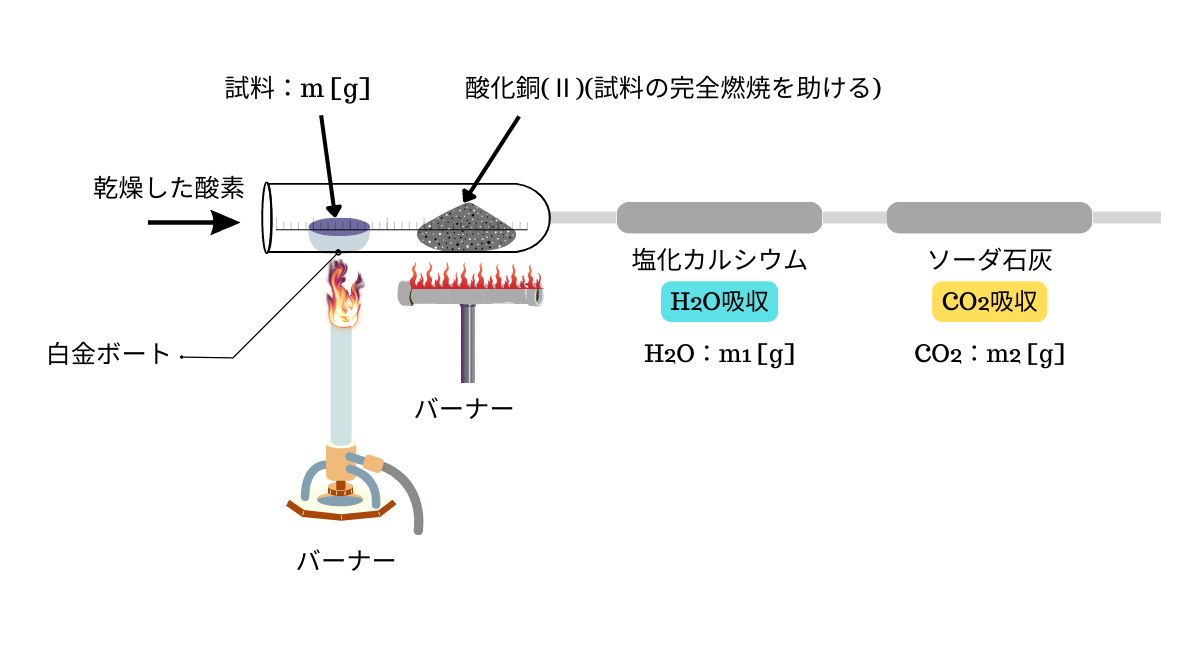
この実験装置を用いて元素分析をする際の手順について説明します。全部で6ステップあります。
- 純粋な試料の質量m [g]を正確に測定します。
- この試料を酸素中で完全に燃焼させて、水と二酸化炭素にし、水は塩化カルシウムに、二酸化炭素はソーダ石灰に吸収させます。
- 吸収により増加した質量から、生成した水の質量\(m_1\) [g]と二酸化炭素の質量\(m_2\) [g]をもとめます。
- \(m_1\)と\(m_2\)から、水素の質量\(m_H\) [g]と炭素の質量\(m_C\) [g]を計算します。
- はじめの試料の質量から炭素と水素の質量(\(m_1 + m_2\))を引いて、残りを酸素の質量\(m_O\) [g]とします。
- 各元素の質量をその原子量で割り、簡単な整数比\(x : y : z \)にする。これにより組成式\(\mathrm{C_xH_yO_z}\)が決まる。
上記のステップで注意することが2点あります。この2点を注意しておけば問題ありません。
- 1. 塩化カルシウム管とソーダ石灰管の順序を逆にしてはいけない!
-
ソーダ石灰は、二酸化炭素の他に水も吸収するという特徴を持っています。
もし、塩化カルシウム管より前にソーダ石灰管を配置した場合、ソーダ石灰管が二酸化炭素と水の両方を吸収してしまうため、それぞれの質量をもとめることができなくなってしまいます。よって、本実験装置は必ず塩化カルシウム管→ソーダ石灰管の順に設計しなくてはいけません。
- 2. \(m_H\), \(m_C\)は\(m_1\), \(m_2\)とは一致しない!
-
水素\(\mathrm{H}\)の質量\(m_H\)をもとめる場合、その式は、
\( (水素原子の質量) = (水蒸気\mathrm{H_2O}の質量) \times (水蒸気中の水素の割合) \)
\( \qquad \qquad \qquad \quad = m_1 \times \displaystyle\frac{(\mathrm{H}の原子量) \times 2}{\mathrm{CO_2}の分子量} \)
となります。
同様に、炭素\(\mathrm{C}\)の質量\(m_C\)をもとめる場合、その式は、\( (炭素原子の質量) = (二酸化炭素\mathrm{CO_2}の質量) \times (二酸化炭素中の炭素の割合)\)
\( \qquad \qquad \qquad \quad = m_2 \times \displaystyle \frac{\mathrm{C}の原子量}{\mathrm{H_2O}の分子量}\)
となります。
\(m_1\), \(m_2\)をそのまま水素、炭素の質量にしてしまわないように注意しましょう。
解説1:元素分析
図は、元素分析装置を模式的に示したものである。炭素と水素からなる化合物10.5 mgを完全燃焼させたところ、水18.9 mgと二酸化炭素30.8 mgを得た。
(1) 酸化銅(Ⅱ)はどのような役割をしているか。
2021セミナー化学 | 第一学習社
(2) 塩化カルシウム管とソーダ石灰管は、それぞれどのような役割をしているか。
(3) 塩化カルシウム管とソーダ石灰管の順番を逆にしてはいけないのはなぜか。
(4) 元素分析の結果から、化合物中の炭素原子と水素原子の質量パーセントを求めよ。
- (1) 酸化銅(Ⅱ)はどのような役割をしているか。
-
炭素と水素からなる有機化合物を燃焼させると水と二酸化炭素が発生します。
しかし同時に、不完全燃焼による一酸化炭素\(\mathrm{CO}\)も発生します。一酸化炭素があっては炭素の正しい質量を算出できないため、酸化銅(Ⅱ)\(\mathrm{CuO}\)を使って一酸化炭素を酸化し二酸化炭素に変換します。反応:\(\mathrm{CO} + \mathrm{CuO} \longrightarrow \mathrm{CO_2} + \mathrm{Cu} \)
A. 試料の不完全燃焼によって生じた一酸化炭素を酸化して、二酸化炭素にする。
- (2) 塩化カルシウム管とソーダ石灰管は、それぞれどのような役割をしているか。
-
「有機化合物の定量的元素分析と組成式の決定」のステップ2に該当します。
A. 塩化カルシウム管:試料の燃焼によって生じた水蒸気を吸収する。ソーダ石灰管:二酸化炭素を吸収する。
- (3) 塩化カルシウム管とソーダ石灰管の順番を逆にしてはいけないのはなぜか。
-
「有機化合物の定量的元素分析と組成式の決定」の注意点の1番に該当します。
A. ソーダ石灰は二酸化炭素と水蒸気の療法を吸収するため、順番を逆にすると、ソーダ石灰管で二酸化炭素と水蒸気の両方が吸収されてしまい、それぞれの質量を測定できなくなるから。
- (4) 元素分析の結果から、化合物中の炭素原子と水素原子の質量パーセントを求めよ。
-
この化合物10.5 mg中の各元素の質量は
水素:\( 18.9 \times \displaystyle\frac{1.0 \times 2}{18} = 2.10\) [mg]
炭素:\( 30.8 \times \displaystyle\frac{12}{44} = 8.40\) [mg]
よって、それぞれの質量パーセントは、
水素:\(\displaystyle\frac{2.10}{10.5} \times 100 = 20.0 \) [%]
炭素:\(\displaystyle\frac{8.40}{10.5} \times 100 = 80.0 \) [%]
A. 炭素原子:80.0%、水素原子:20.0%
問題2:組成式・分子式の決定
炭素、水素、酸素からなる有機化合物について元素分析をした結果、炭素は40%、水素は6.7%、酸素は53.3%であり、別の実験から求めた分子量は60であった。この有機化合物の組成式および分子式を求めよ。
2021セミナー化学 | 第一学習社
略解
組成式:\(\mathrm{CH_2O}\)、分子式:\(\mathrm{C_2H_4O_2}\)
テキスト2:組成式・分子式の決定
まず、各元素の質量をその原子量で割り、簡単な整数比\(x : y : z \)にすることとで組成式\(\mathrm{C_xH_yO_z}\)が決まります。どうしてこのようになるのか説明します。
具体例で考えると簡単です。例えば、各元素の質量が炭素12g、水素2g、酸素16gだったとします。
これをその原子量で割ると、
炭素:\(\displaystyle \frac{12}{12}=1\)、水素:\(\displaystyle\frac{2}{1}=2\)、酸素:\(\displaystyle\frac{16}{16}=1\)
となり、最も簡単な整数比は炭素:水素:酸素=1:2:1となります。
質量を原子量で割ったものはその原子の原子数を表すため、この比は、化合物中に含まれるそれぞれの元素の割合を表しています。つまり、組成式となるのです。
有機化合物の分子は、組成式の式量の整数倍になります。したがって、組成式の式量がもとまると
\((組成式の式量) \times n = (分子量) \qquad (nは整数) \qquad (1) \)
という式が成り立ちます。
また、\((分子式)=(組成式)_n\)となるので、分子式をもとめることができます。
解説2
今回の問題では、炭素40%、水素6.7%、酸素53.3%という質量%なので、質量パーセントをその分子量で割って
炭素:水素:酸素=\(\displaystyle\frac{40}{12}:\displaystyle\frac{6.7}{1.0}:\displaystyle\frac{53.3}{16}=3.33:6.7:3.33=1:2:1 \)
となります。よって、組成式は\(\mathrm{CH_2O}\)となり、その式量は30である。
式(1)を用いると、今回の分子量は60なので
\( n= \displaystyle\frac{60}{30}=2\)
となります。よって、分子式は\(\mathrm{C_2H_4O_2}となります。
A. 組成式:\(\mathrm{CH_2O}\)、分子式:\(\mathrm{C_2H_4O_2}\)
まとめ
元素分析で構造式を決定する方法について解説しました。
本記事の重要事項を下記にまとめました。復習に役立ててください!
- 成分元素の検出方法の例について
- 有機化合物の定量的元素分析と組成式の決定について
- 組成式の決定
- 分子式の決定について
下記SNSにて、情報発信&質問対応を行っています。
質問については、本サイト内の内容に限らず勉強の相談等なんでもOKです。
本サイト運営者のかんたが直接お答えしております。お気軽にお問い合わせください!
X(旧Twitter)
LINE
Instagram
YouTube


質問・コメント