気体の溶解度はどうして難しい?
気体の溶解度は固体の溶解度と同じく、溶媒のどれだけその気体が溶けているかを表します。
しかし、その表し方は固体のときとは異なり、温度との関係もイメージしにくいので間違えやすいです。
また、圧力と体積が関わってくると少し分かりにくくなってきてしまうかもしれません。
そこで、今回は
気体の溶解度が”分かる”
というテーマで、わかりやすく解説していきます。
本記事は以下のような人におすすめです!
本記事の内容の演習問題も用意しています。演習問題で理解度を確認したい方は是非チェックしてみてください!

この記事を読んで、気体の溶解度を完璧に理解しましょう!
テキスト:気体の溶解度
気体の溶解度の表し方
まず、気体の溶解度の表し方を確認しましょう。
気体の溶解度:圧力(分圧)\(\mathrm{1.013 \times 10^5 \, Pa}\)の気体が溶媒\(\mathrm{1 \, L}\)に溶けるときの体積 [L]を、標準状態の体積に換算した値。
言葉にすると、少し難しいかもしれません。
しかし、気体の溶解度で大切なことはたった1つです。
それは・・・
気体の溶解度をモル体積\(\mathrm{22.4 \, L/mol}\)で割ると、溶解している気体の物質量が求まる。
ということです。
具体例を考えて見ましょう。
水素の溶解度は、\(\mathrm{0.021}\)です。
これは、水素が、\(\mathrm{0 \, ℃}\)、\(\mathrm{1.013 \times 10^5 \, Pa}\)で水\(\mathrm{1 \, L}\)に\(\mathrm{0.021 \, L}\)溶けるということです。
ここで、\(\mathrm{0.021 \, L}\)は標準状態の体積を表しているので、これをモル体積\(\mathrm{22.4 \, L/mol}\)で割ることで溶解している気体の物質量がわかります。
\(\mathrm{\displaystyle\frac{0.021}{22.4}=9.4 \times 10^{-4}}\)
よって、溶解している水素は\(\mathrm{9.4 \times 10^{-4} \, [mol]}\)であることがわかります。
 かんた
かんた気体の溶解度は、「モル体積で割ることで、溶解している気体の物質量を求めることができる。」ということを覚えておこう!
ヘンリーの法則
次に、ヘンリーの法則について確認します。
ヘンリーの法則:一定量の溶媒に溶け込む気体の質量は、一定温度のもとでは、その気体の圧力(混合気体の場合には分圧)に比例する。
ヘンリーの法則は言葉で説明されてもあまりしっくりこないと思うので、図を使ってイメージしましょう。
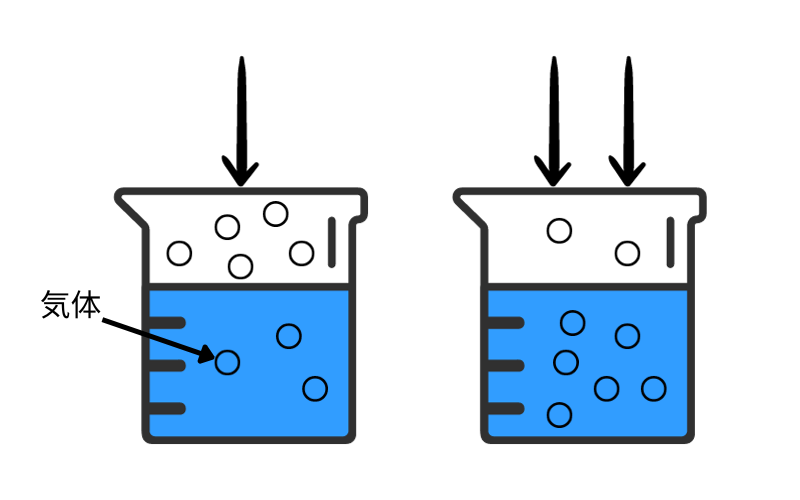

図のように、一定量の溶媒にある圧力で3粒分の気体が溶けていたとします。
ここで、温度を変えずに圧力を2倍にすると、溶ける気体の量も2倍の6粒分になります。
これをわかりやすい具体例で考えてみます。
例えば、\(0 \, ℃\)、\(\mathrm{1.0 \times 10^5 \, Pa}\)で水\(\mathrm{1 \, L}\)に\(\mathrm{1 \, mol}\)溶ける気体があるとします。
この気体を、温度一緒で圧力を2倍の\(\mathrm{2.0 \times 10^5 \, Pa}\)にすると、ヘンリーの法則から\(\mathrm{2 \, mol}\)溶けるということになります。



質量と物質量はモル質量を使って簡単に変換できるから、どちらの場合でもヘンリーの法則が成り立つね!
ヘンリーの法則と溶解する気体の体積
最後に、少し難しいヘンリーの法則と溶解する気体の体積の関係について解説します。
一般的な教科書には以下のように書かれていると思います。
一定の温度のもとで一定量の溶媒に溶ける気体の体積は、
その気体の圧力下で測ると一定であり、一定の圧力下で測ると溶かしたときの気体の圧力に比例する。
これを見て、全くわからないなぁ…と思った人も安心してください。
これらを一発で簡単に理解する方法があります。
それは、気体の状態方程式を使うということです。



でも、溶解している気体に状態方程式って使えるの?
そうです。厳密に言うと溶解している気体には気体の状態方程式は成り立ちません。
しかし、溶解していない気体には気体の状態方程式が成り立つので、全体からそれを引いた分が溶解している気体であると考えると、溶解している気体にも状態方程式が成り立つといえます。
さて、では溶解する気体の体積について状態方程式から考えてみましょう。


まず、その気体の圧力下で測った場合、体積は常に一定になります。


一方、一定の圧力下で測ると、溶かしたときの気体の圧力に比例します。
このように、気体の状態方程式をその都度適応することで体積は簡単に求められます。
まとめ
今回は、気体の溶解度について解説しました。
本記事の重要事項を下記にまとめました。復習に役立ててください!
- 気体の溶解度の表し方について
- ヘンリーの法則について
- ヘンリーの法則と溶解する気体の体積について
本記事の内容の演習問題も用意しています。演習問題で理解度を確認したい方は是非チェックしてみてください!


下記SNSにて、情報発信&質問対応を行っています。
質問については、本サイト内の内容に限らず勉強の相談等なんでもOKです。
本サイト運営者のかんたが直接お答えしております。お気軽にお問い合わせください!
X(旧Twitter)
LINE
Instagram
YouTube


質問・コメント