固体の溶解度は「言葉」が難しい!
固体の溶解度と聞くと、「溶解度」「溶液」「溶媒」「溶質」「析出量」など色々な言葉が出てきてややこしいと感じたことはありませんか?
固体の溶解度を理解する上でこれらの言葉は非常に重要ですが、私自身もしっかり理解できていませんでした。
そこで、今回は
固体の溶解度が”分かる”
というテーマで、再結晶についても触れながらわかりやすく解説していきます。
本記事は以下のような人におすすめです!
本記事の内容の演習問題も用意しています。演習問題で理解度を確認したい方は是非チェックしてみてください!

この記事を読んで、固体の溶解度を得意分野にしてしまいましょう!
テキスト
固体の溶解度を理解する上で重要な事項を、それぞれのキーワードごとに確認して行きましょう。
溶解平衡
まず、溶解平衡という言葉について確認しましょう。
溶解平衡:見かけ上溶解が止まった状態のこと。
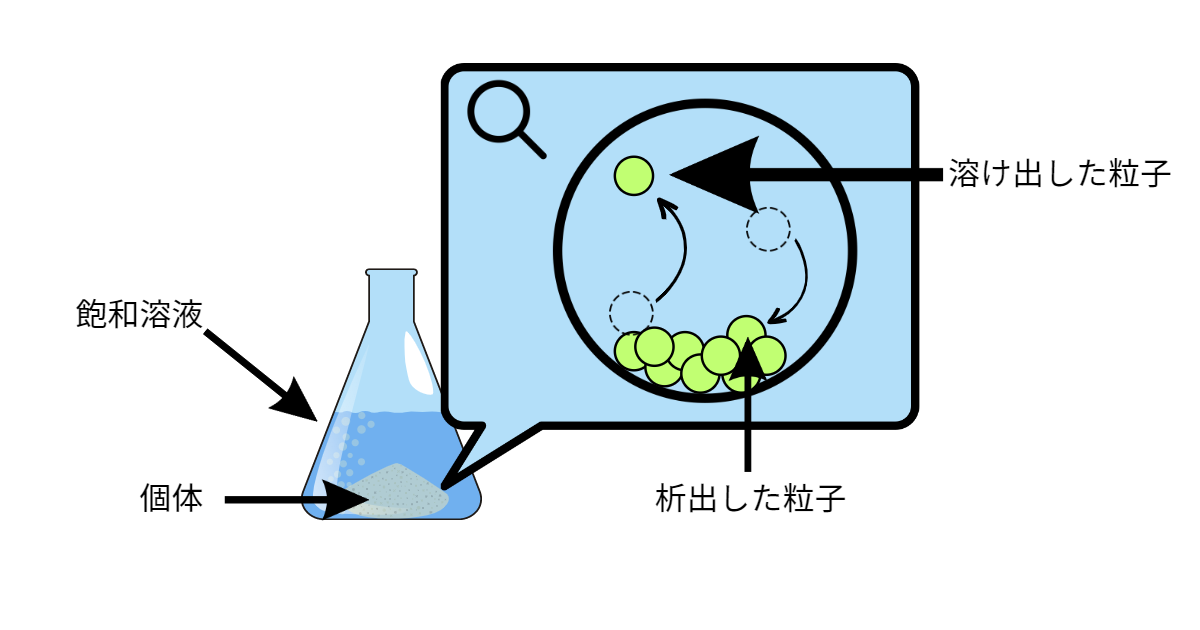
溶解平衡とは、見かけ上溶解が止まった状態のことをいいます。
図のように、固体を溶媒に入れると、固体が溶媒中に溶け出します。しかし、ある一定のところで、単位時間に固体から溶け出す粒子数と溶液中から析出する粒子数が同じになります。
この、「溶け出す粒子数=析出する粒子数」が成立しているときが溶解平衡です。
また、溶解平衡の状態の溶液のことを飽和溶液といいます。
溶解平衡は、溶解度を考える上で必要な知識となるのでしっかり理解しておきましょう!
溶解度
次に、溶解度という言葉について確認していきます。
溶解度:溶媒100gに溶かすことができる溶質の質量(g単位)の最大の数値。
言葉で説明されてもあんまり良くわかりませんよね!
そこで、具体例を考えてみましょう。
「硫酸銅(Ⅱ)の水に対する溶解度は、40℃で25である。」という場合の状況について考えます。
これは、「48℃において、溶媒(水)100gに溶かすことができる溶質(硫酸銅(Ⅱ))の質量の最大値は25gである。」ということです。
これを図に表すと下のような図になります。
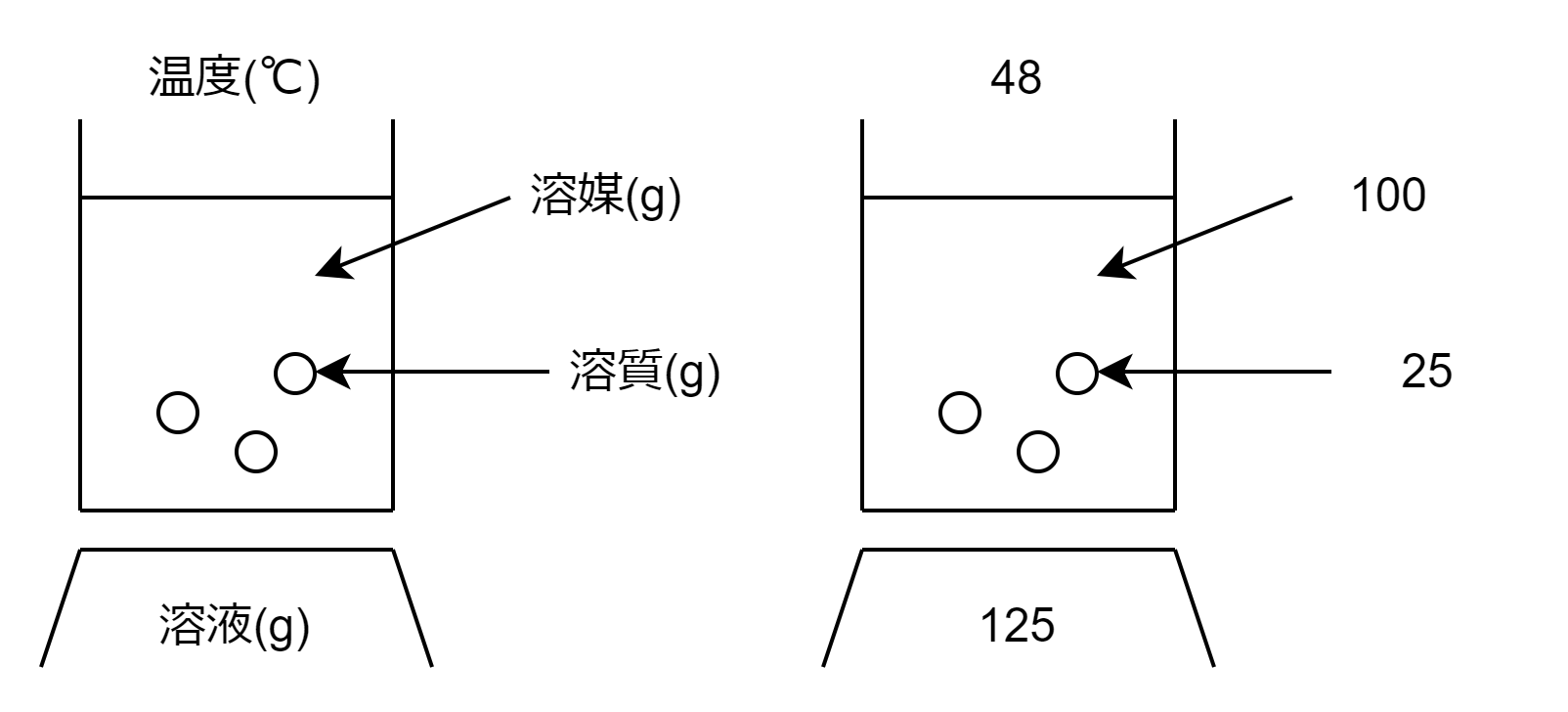
図の見方としては、
溶媒と溶質が入った入れ物はビーカー、下の溶液の質量が書かれているものは重さを測る機械と考えるとわかりやすいと思います。(ビーカーの重さは無視しています。)
このように図で表すと、
「48℃で、100gの水に最大25gの硫酸銅(Ⅱ)が溶ける。」ということがすぐわかります。
 かんた
かんたこの図のことを溶解度図と呼ぶよ。(筆者が勝手につけた名前だから好きに呼んでくれて構わないよ笑)
この図を使うと、以下のような\(\mathrm{CuSO_4 \cdot 5H_2O}\)の析出量を求める問題が簡単に解けます。気になる人は、ぜひ確認してみてください。


水和物の溶解度
最後に、意味を誤解しがちな水和物の溶解度について解説します。
その前に、水和物、無水物について確認します。
水和物:水和した水分子を含む結晶。ex) 硫酸銅(Ⅱ)の結晶 \(\, \mathrm{CuSO_4 \cdot 5H_2O}\)
無水物(無水塩):水分子を含まない結晶。 ex) 硫酸銅(Ⅱ) \( \, \mathrm{CuSO_4}\)
硫酸銅(Ⅱ)は、結晶化すると周囲の水分子とくっついて\(\mathrm{CuSO_4 \cdot 5H_2O}\)のように水を含んだ水和物となります。
このとき、水分子は銅(Ⅱ)イオンや硫酸イオンと強く結びついていて、このような水分子を水和水(結晶水)と呼びます。
一方、水分子がくっついていない\(\mathrm{CuSO_4}\)は、無水物(無水塩)に分類されます。
さて、ではこれらの言葉を使って水和物の溶解度を表すと下のようになります。
水和物の溶解度:水に対する水和物の溶解度は、飽和溶液中の水100gに溶けている無水物のg単位の質量の数値で表される。
さて、どういうことか具体例を見てみましょう。
「硫酸銅(Ⅱ)の水和物\(\mathrm{CuSO_4 \cdot 5H_2O}\)の溶解度は、60℃で40gである。」という状況について考えます。
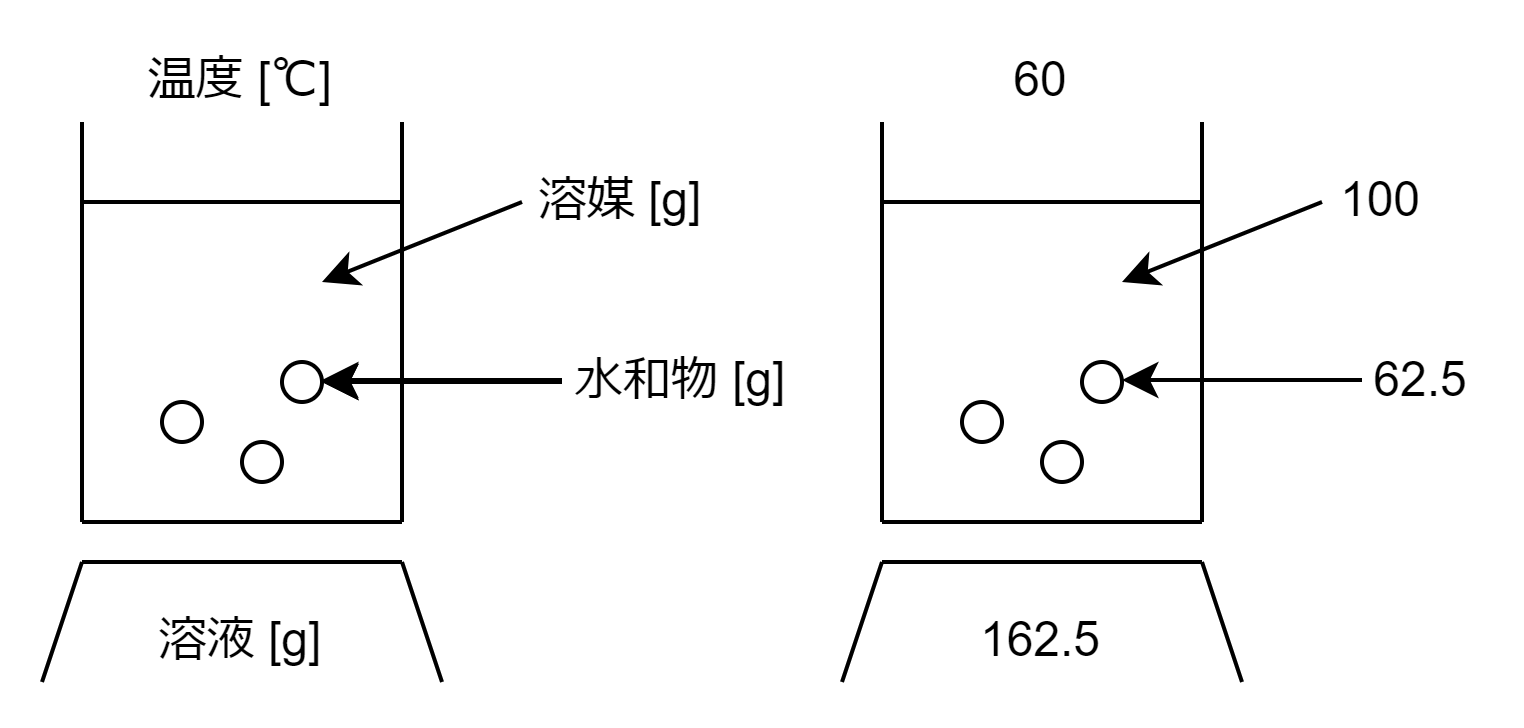

62.5 [g]って何?
なぜ、水和物の質量が62.5gと分かったについて説明します。
水和物の溶解度は、水100gに対する無水物の質量 [g]で表されます。
そこで今回、60℃における硫酸銅(Ⅱ)の結晶\(\mathrm{CuSO_4 \cdot 5H_2O}\)の質量を\(\mathrm{x \, [g]}\)とします。
\(\mathrm{CuSO_4 \cdot 5H_2O}\)の式量は
\( \mathrm{160 + 18 \times 5 = 250}\)
です。
また、\(\mathrm{CuSO_4}\)の分子量は160であるため、
水和物\(\mathrm{CuSO_4 \cdot 5H_2O}、\mathrm{x \, [g]} \)中に含まれる無水物\(\mathrm{CuSO_4}\)の質量は
\( \mathrm{ x \times \displaystyle\frac{160}{250} \, [g] \quad \cdots (1)}\)
となります。
今回は水100gであるので、(1)が40gとなれば60℃において飽和溶液となります。
\(\mathrm{x \times \displaystyle\frac{160}{250} = 40}\)
\( \mathrm{x=62.5}\)
よって、
60℃おいて水100gに\(\mathrm{CuSO_4 \cdot 5H_2O}\)が62.5 [g]溶けていれば、溶液は飽和溶液であるといえます。



水和物の溶解度は、無水物の質量(g)に着目することを忘れないようにしよう!
まとめ
今回は、固体の溶解度について解説しました。
本記事の重要事項を下記にまとめました。復習に役立ててください!
- 溶解平衡について
- 溶解度について
- 水和物の溶解度について
本記事の内容の演習問題も用意しています。演習問題で理解度を確認したい方は是非チェックしてみてください!


下記SNSにて、情報発信&質問対応を行っています。
質問については、本サイト内の内容に限らず勉強の相談等なんでもOKです。
本サイト運営者のかんたが直接お答えしております。お気軽にお問い合わせください!
X(旧Twitter)
LINE
Instagram
YouTube


質問・コメント