\(\mathrm{CuSO_4 \cdot 5H_2O}\)の析出量をもとめたい!
固体の溶解度の分野で\(\mathrm{CuSO_4 \cdot 5H_2O}\)の析出量をもとめる問題は頻出ですが、理解するのに苦労する人が多いと思います。
私も、「溶液」「溶媒」「溶質」「溶解度」「析出量」など、未知数となりうる値が多くて、毎回解くときに悩んでしまっていました。
そこで、今回は
「\(\mathrm{CuSO_4 \cdot 5H_2O}\)の析出問題が”解ける”」
というテーマで、わかりやすく解説していきます。
本記事は以下のような人におすすめです!
本記事の内容のテキストも用意しています。テキストで基本事項を確認したい方は是非チェックしてみてください!

この記事を読んで、\(\mathrm{CuSO_4 \cdot 5H_2O}\)の析出問題を攻略しましょう!
問題
硫酸銅(Ⅱ)\(\mathrm{CuSO_4}\)の48℃における飽和水溶液100gを12℃まで冷却すると、何gの結晶が析出するか。ただし、硫酸銅(Ⅱ)の水に対する溶解度は、48℃で25、12℃で15であり、析出する結晶は\(\mathrm{CuSO_4 \cdot 5H_2O}\)である。
2021セミナー化学 | 第一学習社
略解
14 g
ポイント
 悩む人
悩む人本当に3ステップだけでできるの?
そう思っている人のために、ズバリその3ステップをお伝えします。それは…
です!!
この3ステップを繰り返すことで答えを導出することができます。
言葉だと分かりづらい部分もあると思うので実際に問題を解いて確認していきましょう。
溶解度図は、溶解度をわかりやすく図で表現したものです。詳しく知りたい方は下記記事を確認してみてください!


解説
硫酸銅(Ⅱ)\(\mathrm{CuSO_4}\)の48℃における飽和水溶液100gを12℃まで冷却すると、何gの結晶が析出するか。ただし、硫酸銅(Ⅱ)の水に対する溶解度は、48℃で25、12℃で15であり、析出する結晶は\(\mathrm{CuSO_4 \cdot 5H_2O}\)である。
2021セミナー化学 | 第一学習社
まず、48℃における飽和水溶液100gに含まれる溶質(硫酸銅(Ⅱ)\(\mathrm{Cu_SO_4}\))の質量を\(x\)とします。(STEP1)
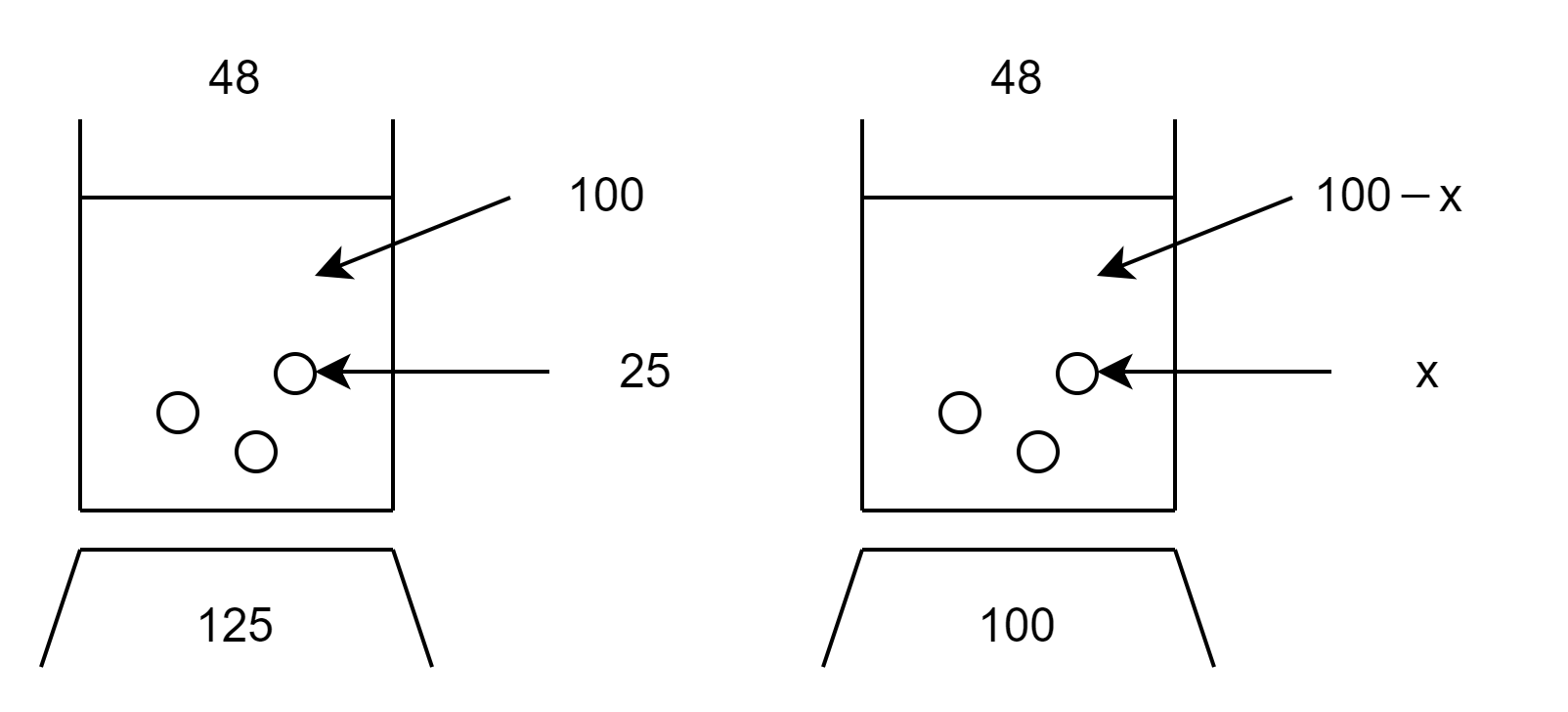

次に溶解度図を上のように書きます。(STEP2)
大切なのはどちらも同じ温度で飽和溶液であるということです。
当然、同じ温度でないと溶解度が変わってきてしまうので、温度が必ず一致していることを確認しましょう。
今回は、\(\displaystyle\frac{溶質}{溶液}\)で立式します。(STEP3)
\( \displaystyle\frac{溶質}{溶液}=\displaystyle\frac{25}{100+25}= \displaystyle\frac{x}{100}\) \(\quad\) \( x=20 \) [g]
次に12℃まで冷却したときに析出する硫酸銅(Ⅱ)五水和物\(\mathrm{CuSO_4 \cdot 5H_2O}\)の質量を\(y\)とします。(STEP1)
このとき、析出する結晶\(y\) [g]に含まれる\(\mathrm{CuSO_4}\)の質量は、
\( y \times \displaystyle\frac{\mathrm{CuSO_4}の式量}{\mathrm{CuSO_4 \cdot 5H_2O}の式量}=y \times \displaystyle\frac{160}{250} \) [g]
よって、\(y\) [g]析出した後の溶液に含まれる溶質(\(\mathrm{CuSO_4}\))の質量は\( x- \displaystyle\frac{160}{250}y \) [g]となります。
よって、\(x=20\)なので溶解度図は以下のようになります。(STEP2)
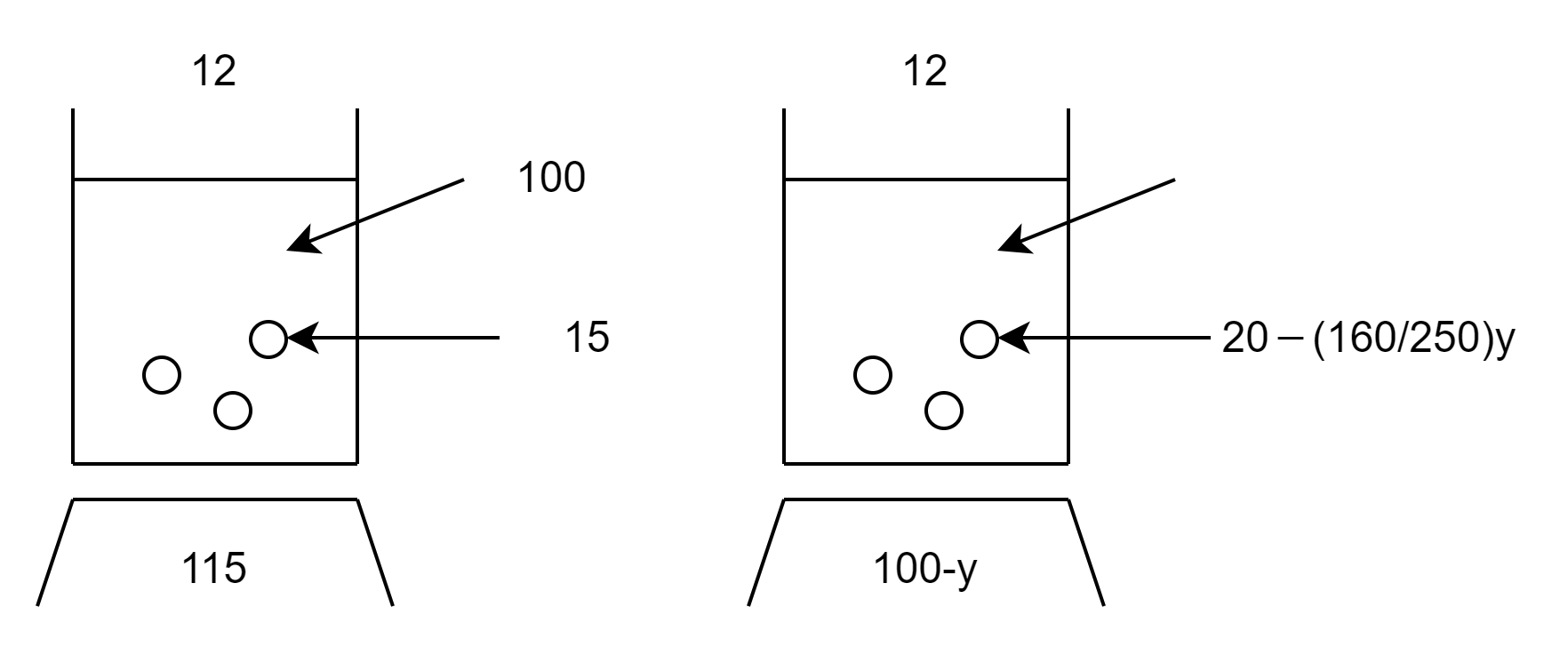

12℃における溶解度図から\(\displaystyle\frac{溶質}{溶液}\)で立式すると、
\(\displaystyle\frac{溶質}{溶液}=\displaystyle\frac{15}{100+15}=\displaystyle\frac{20-\displaystyle\frac{160}{250}y}{100-y} \)
となります。(STEP3)
これを\(y\)について解くと、\(y=14\) よって、析出する結晶は14gとなります。
A. 14 g
まとめ
\(\mathrm{CuSO_4 \cdot 5H_2O}\)の析出量をもとめる方法について解説しました。
本記事の内容のテキストも用意しています。テキストで基本事項を確認したい方は是非チェックしてみてください!


下記SNSにて、情報発信&質問対応を行っています。
質問については、本サイト内の内容に限らず勉強の相談等なんでもOKです。
本サイト運営者のかんたが直接お答えしております。お気軽にお問い合わせください!
X(旧Twitter)
LINE
Instagram
YouTube


質問・コメント